modelo atómico de bohr: Aquí te explicaremos qué es el modelo atómico de Bohr de una forma rápida y sencilla, en que consiste, para qué sirve, características, maqueta. Niels Bohr fue un físico Danés nacido en 1885, después de haber finalizado su doctorado trabajó con el equipo de Ernest Rutherford en los laboratorios Cavendish de Cambridge.
👉 Movimiento de electrones según el modelo atómico de Bohr
Antes del año 1913, se pensaba que un átomo consistía en un pequeño núcleo pesado cargado positivamente, llamado núcleo, rodeado por electrones planetarios negativos ligeros que giraban en órbitas circulares de radios arbitrarios.
Bohr enmendó esa visión del movimiento de los electrones planetarios para alinear el modelo con los patrones regulares (series espectrales) de luz emitida por luz real de átomos de hidrógeno.
Al limitar los electrones en órbita a una serie de órbitas circulares que tienen radios discretos, Bohr explico la serie de longitudes de onda discretas en el espectro de emisión del hidrógeno.
Y propuso que la luz irradiada de los átomos de hidrógeno sucedía solo cuando un electrón hacía una transición de una órbita exterior a una más cercana al núcleo. La energía perdida por el electrón en el salto abrupto es exactamente la misma que la energía de luz emitida en esa transición.

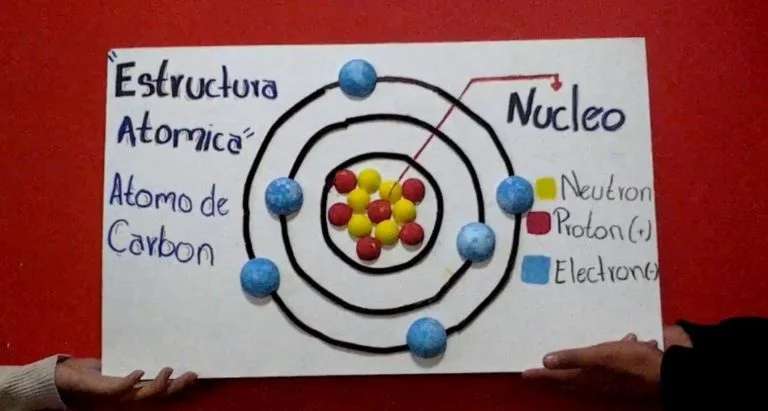
De acuerdo con la teoría de Bohr, existen 2 tipos de electrones, los internos y externos o de valencia y se encuentran en niveles definidos de energía a las mismas distancias.
Los electrones poseen la energía más baja a medida esté más cerana al núcleo, mientras que los electrones ubicados en las órbitas más alejada al núcleo poseen el nivel energético más alto, es por eso que las órbitas que ocupa cada electrón se denomina como niveles energeticos.
Primero se distribuyen los electrones en los niveles de menor energía y luego en los niveles más altos, esta distribución se conoce como configuración electrónica.
👉 Ejemplo del modelo atómico de Bohr
Por ejemplo, el magnesio está representado en la tabla periódica con las letras MG y cuenta con 12 electrones 12 protones y 13 neutrones, pero tomaremos en cuenta la cantidad de electrones para el ejemplo.
En dicha tabla periódica el MG se encuentra en el 3er nivel de energía lo que significa que la configuración electrónica de este elemento constará de 3 órbitas.

Siendo así en el primer nivel deben colocarse dos electrones en el segundo ocho y los dos electrones restantes se colocan en el tercer nivel.

Otro ejemplo, el fósforo representado con la letra P, tiene 15 electrones 15 protones y 16 neutrones, al igual que el magnesio se encuentra en el tercer nivel energético.
Por lo que colocaremos 2 electrones en su primera órbita 8 en la siguiente y 5 en el último nivel de energía.
De acuerdo con el modelo atómico de Bohr los electrones pueden saltar de niveles, cuando un electrón cambia de una órbita exterior, a una interior pierde energía que se desprende en forma de fotos o luz, si se mueve de una interior a una exterior el electrón gana energía.
Al salto de una órbita a otra se le denomina un cuántico de energía de ahí que la frase salto cuántico se refiere a un salto o cambio brusco de energía.
El modelo diseñado por Bohr también explica la estabilidad de la materia y la conformación de los enlaces químicos y es la base del modelo que se utiliza en la actualidad, además fue el precursor para la creación de la mecánica cuántica
🤔 ¿Qué es el Modelo atómico de Bohr?
El modelo según la teoría de Niels Bohr es un modelo clásico del átomo, pero este fue el primer modelo atómico en el cual se introduce una cuantificación a partir de ciertos postulados.
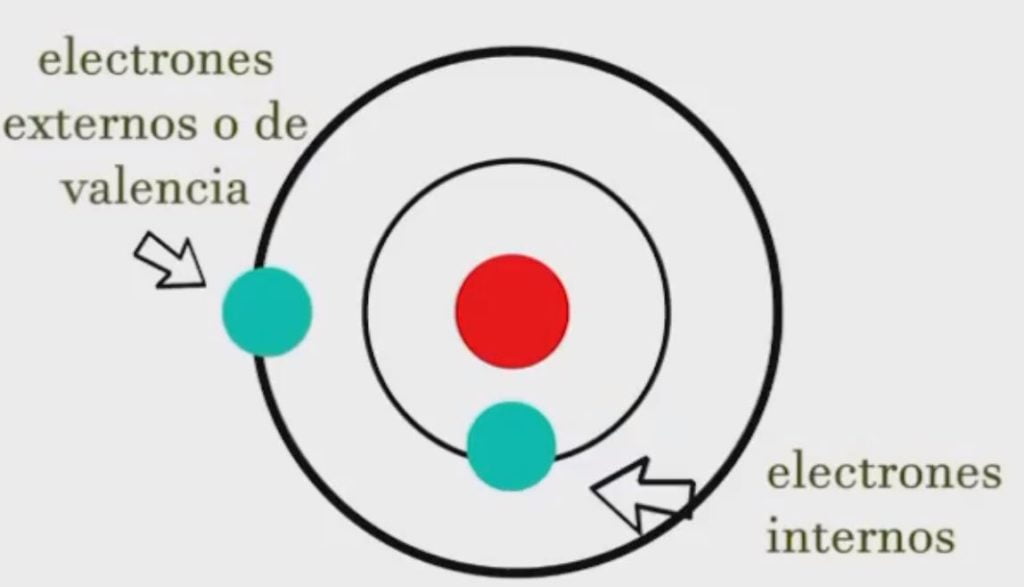
Según el modelo atómico de Bohr, en el núcleo se encuentran los protones y los neutrones y alrededor de él hay 7 niveles de energía.
En dichos niveles van girando los electrones como si fuera un sistema planetario por eso se lo conoce también como el sistema planetario de Bohr.
En el cual en esos niveles de energía se encuentran girando los electrones, pero no es que pueda girar alrededor de esos niveles de energía cualquier cantidad de electrones.
Cada nivel tiene una cantidad máxima que puede acaparar de electrones por ejemplo el nivel 1 que también se conoce como el nivel (K), que pueden entrar solamente 2 electrones como máximo.
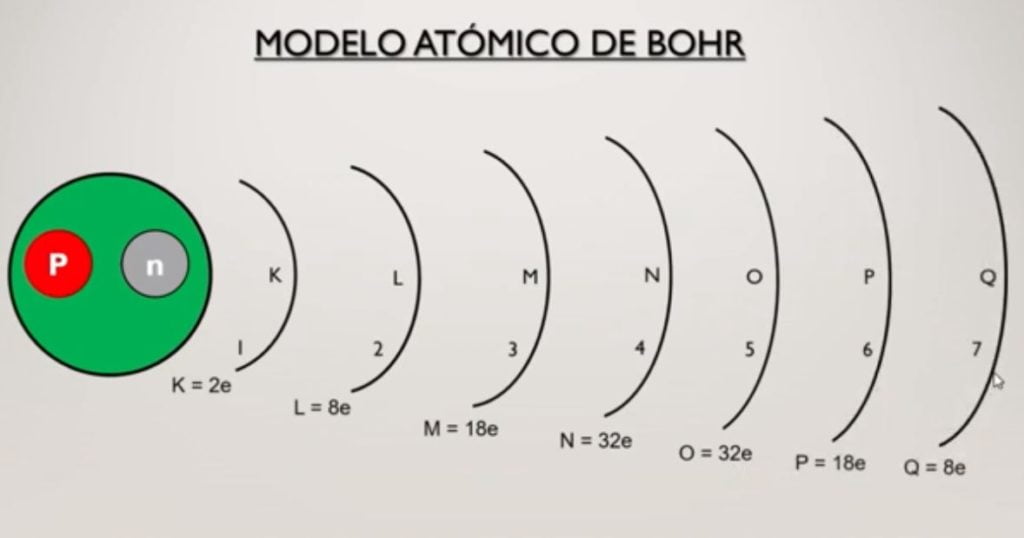
En el nivel 2 que también se conoce como a nivel (L) pueden girar como máximo 8 electrones, en el nivel tres (M) pueden ser 18, en el nivel 4 (N) 32, en el 5 (O) 32, sexto (P) 18 y por último en el séptimo (Q) que es el nivel que pueden girar 8 electrones como máximo.
El modelo atómico de Bohr es un modelo de la estructura del átomo que describe el átomo como una pequeña bola en el espacio. La bola se mueve alrededor del núcleo y está rodeada por electrones en órbitas circulares. Los electrones no pueden estar en cualquier lugar, sino que solo pueden existir en ciertos niveles de energía bien definidos.
🤔 ¿Cuáles son las características del modelo atómico de Bohr?
La principal característica del modelo atómico de Bohr es que los electrones no pueden emitir radiación cuando se encuentran en las órbitas permitidas. Estas órbitas son estables y no requieren energía adicional para mantener a los electrones dentro de ellas.
Sin embargo, si los electrones son forzados a salir de sus órbitas permitidas, entonces comenzarán a emitir radiación electromagnética con una longitud de onda característica.
Otra característica importante del modelo atómico de Bohr es la manera en que describe el movimiento de los electrones alrededor del núcleo. Según este modelo, los electrones se mueven continuamente alrededor del núcleo, pero solo cambian su posición cuando absorbemos o emitimos radiación electromagnética.
De esta forma, el movimiento constante de éste tiene lugar “trampa” cuándo se ve sometido a un campo de fuerza externo en contraste con lo clásico donde permanecería quieto en reposo . Esto es debido a que todo objeto tiende a conservar su movimiento inicial aunque no haya una fuerza actuando en sentido opuesto a dicho movimiento correctivo.
También te puede interesar: ¿Qué es un cuadro comparativo?
➡️ Modelo atómico de Bohr características principales
- Las características fundamentales de este modelo son las siguientes:
- Los electrones solo pueden girar en órbitas a determinadas distancias del núcleo.
- En las órbitas o capas los electrones que irán con energía constante.
- Cada capa o nivel de energía tienen un número diferente de electrones.
- El número de electrones por nivel es 2n al cuadrado.
- Donde n es el número de nivel (N=1,2,3…)
▶️ Índice: