Átomo: El átomo es la unidad más diminuta de la materia, está constituida por un núcleo, neutrones y protones y tiene consigo las propiedades de un elemento químico. Se trata de una partícula estable y de menor tamaño, que se encarga de mantener todas las propiedades de un elemento, o sea, la parte más pequeña de una materia que medirse.
🤔¿De que consta cada Átomo?

Cada uno de los átomos consta de partes aún más pequeñas, y a estas se le denomina partículas subatómicas, viéndose también incluidos los neutrones, electrones y protones. Los átomos se fusionan y producto de ello surgen las moléculas que posteriormente van a constituir sólidos, líquidos y gases.
🤔 ¿Que es un átomo?
👉 Conformación del átomo
El átomo se agrupa en dos regiones distintas: en primer lugar tenemos al núcleo, sitio donde habitan los neutrones y protones, y el segundo es la nube o también llamados orbitales electrónicos, lugar de los electrones.
👉 Núcleo
Esta parte de la estructura funciona como el centro el corazón del átomo, su composición está basada en neutrones y protones. Los dos compuestos constan de masa, pero la carga positiva solamente la tienen los protones.
Cabe señalar, que los átomos en su totalidad cuentan con la misma cantidad de protones, pero las variaciones se presentan en los neutrones. Son denominados isótopos de un elemento a aquellos átomos que poseen una cantidad distinta de neutrones.
Tenemos como ejemplo, el carbono -12 y el carbono -14, ambos son isótopos del elemento carbono, porque cuentan con 6 protones en su núcleo, pero se puede ver que el carbono-12 posee 6 neutrones, y el carbono-14 cuenta con 8 protones.
👉 Orbitales electrónicos
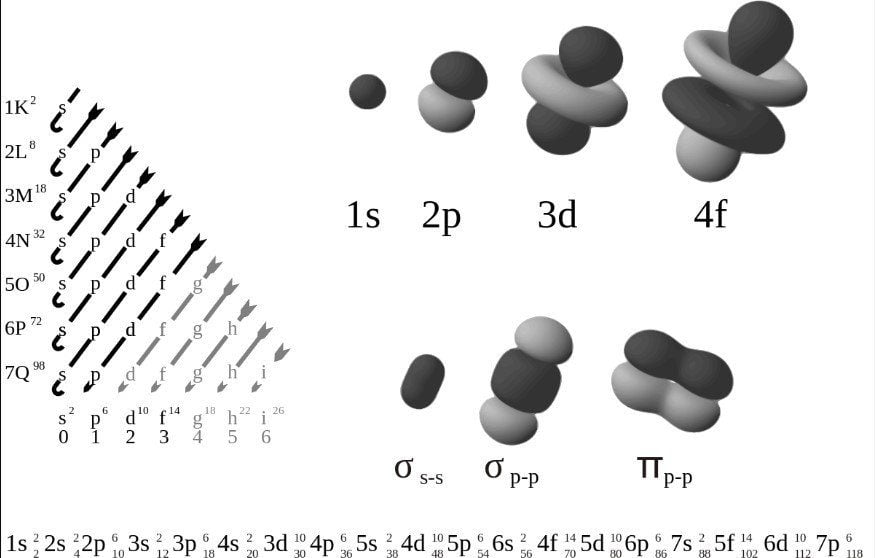
Esta envuelve al núcleo, los electrones habitan allí en una especie de nube, cabe rememorar que los electrones tienen carga negativa. Al momento que un átomo adquiere o sufre la pérdida de electrones, estos son denominados iones.
Supongamos que la estructura del átomo es comparada con una cancha de fútbol, esta abarcaría todo el terreno de juego, pero el núcleo del átomo, sería más igual a un granito de arena situado en el centro del terreno.
🤔 ¿Cuál es la definición de átomo, según leucipo y demócrito?
🤔 Fragmentos de un átomo
✍️ Protón
Como veníamos mencionando con anterioridad, los protones son los únicos que cuentan con carga positiva y esta se ubica en el núcleo del átomo. La masa tiene un peso aproximado de 1,67 x 10-24 gramos, que vendría siendo igual a 1 dalton.
El número atómico del elemento es el que establece la cantidad de protones dentro de un átomo. El hidrogeno por ejemplo, que solo dispone de un solo protón, a causa de que su número atómico es igual a 1.
✍️ Neutrón
Su masa es igual al de un protón, en síntesis, un dalton, constituyéndose como una partícula neutra del núcleo del átomo.
✍️ Electrón
Son partículas subatómicas que rondan en las inmediaciones del núcleo. Posee una masa de 9,11 x 10-28 gramos, lo que equivale a 1/1800 de la masa de un protón, dispones de una masa tan diminuta que es catalogada como despreciable.
Cada uno de los electrones cuentan con cargas negativas, pero estas cargas suelen ser neutras y esto sucede porque tienen tantos protones como electrones, y cuando uno ejecuta una carga positiva produce la cancelación de la carga negativa del otro
👉 Historia del átomo
La conceptualización del átomo como una unidad inseparable remonta del siglo V a de C. Los griegos Demócrito y Leucipo catalogaron al átomo como partículas diminutas y únicas de las que conocían. Demócrito planteó que la variedad clases y combinaciones de estas partículas son las causantes principales de toda la materia.
👉 La primera teoría atómica
John Dalton (1766-1844) era un químico y meteorólogo, señalado como el primero en poder formular la teoría atómica. Dalton ejecutó varios experimentos con gases, que lo encaminaron a lograr formular el concepto de la estructura atómica, esto a inicios del 1800.
👉 La teoría atómica de Dalton determina estos puntos:
- Los átomos que hay en un elemento son todos iguales.
- Los átomos no pueden ser destruidos. Esto ocurre cuando una reacción química establece el reconstrucción de los átomos.
- Los átomos con distintos elementos presentan variaciones en masa y medida.
👉 El hallazgo de los fragmentos del átomo

J. J. Thomson (1856-1940) fue el que descubrió los electrones a base de experimentos, cuando se encontraba investigando acerca de los rayos de tubos catódicos entre los años 1898 y 1903. La teoría de la indivisibilidad de Dalton quedó sin efecto tras el descubrimiento hecho por Thomson.
“El pudin de pasas”, es el nombre por el cual el modelo de Thomson es reconocido, donde plantea que el átomo es una masa de cargas positivas y negativas.
👉 El átomo nuclear
El estudiante de Thomson, Ernerts Rutherford (1871-1937), utilizando la radioactividad, disparó elementos con partículas alfa y encontró que la masa del átomo estaba centrado en un pequeño núcleo con carga proporcional a la masa atómica, consiguiendo de esta forma que quede probada que el átomo no es homogéneo.
también te puede Interesar: Estados de la materia: Qué son, Cuantos son y más
👉 El modelo atómico de Bohr
El protagonista de este modelo es Niels Bohr (1885-1962), fue estudiante de la Universidad de Manchester y compañero de Rutherford. Bohr planteó que el electrón dentro de un átomo de hidrogeno se desplazaría alrededor del núcleo en forma circular. No obstante, el modelo de Bohr fue aplicada en los demás átomos pero la misma no tuvo efecto.
👉 Modelo mecánico cuántico del átomo
Erwin Schrödinger (1887-1961), Werner Heisenberg (1901-1976) y Louis de Broglie (1892-1987) fueron los tres físicos protagonistas de este modelo. El planteamiento de estos científicos derivó al desarrollo de lo que se conoce como mecánica cuántica.
En este modelo, se puede apreciar que el electrón se manifiesta como una onda estacionaria. En un determinado mapa de nube electrónica o densidad, la órbita es la posible repartición espacial de electrones.
A consecuencia de la duda de Heisenberg, el desplazamiento del electrón alrededor del núcleo no pudo establecerse de forma exacta, por ende, las órbitas de Bohr tuvo un resultado fallido.
Como se puede apreciar, los antecedentes históricos del átomo, expresan una serie de hallazgos gracias a la admirable labor de los expertos en la materia.
▶️ Índice:






