Masa atómica relativa: La masa de un átomo es tan pequeña que es difícil medirla usando un dispositivo.
Protones y los neutrones
Por ejemplo, los protones y los neutrones tienen una masa del orden de ![]() . Eso es una billonésima de una billonésima de un kilogramo, ¡demasiado pequeño para medirlo en la práctica!
. Eso es una billonésima de una billonésima de un kilogramo, ¡demasiado pequeño para medirlo en la práctica!

Los científicos necesitaban una forma más efectiva de medir la masa de un átomo. Decidieron usar la masa de un átomo de carbono-12 como base para medir las masas de todos los demás átomos. Definen la masa atómica relativa del átomo de carbono-12 como 12 y resuelven todo a partir de ahí. Esto se conoce como el estándar de carbono-12.
Definición de Masa Relativa
Cuando decimos masa relativa nos referimos a la masa de un átomo o molécula comparada con la de un átomo de carbono-12.
Lo que encontrarás en este artículo
- En este artículo, aprenderemos sobre las masas relativas.
- Primero, discutiremos el estándar de carbono-12.
- Luego lo usaremos para calcular la masa atómica relativa (Ar) y la masa fórmula relativa (Mr).
- También aprenderemos por qué usamos un promedio ponderado de masas.
¿Qué es la masa isotópica relativa?
En la naturaleza, dos de los mismos átomos pueden existir pero tener un número diferente de neutrones.
Definición de un Átomo de un mismo elemento
Cuando un átomo de un mismo elemento tiene diferente número de neutrones, se le llama isótopo.
Definición de Isotópica relativa
La masa de un átomo de un isótopo comparada con la
masa del carbono-12 se denomina masa isotópica relativa .
Información Importante

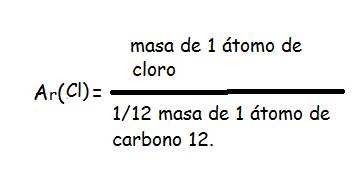
Los científicos miden la masa de un átomo de un isótopo comparándolo con una unidad de masa atómica unificada o 1u. 1u es igual ![]() a la masa de un átomo de carbono-12.
a la masa de un átomo de carbono-12.
Nota: No utilizará esta fórmula en su examen, ¡pero es bueno saberlo!
¿Qué es la masa atómica relativa?
La masa atómica relativa (RAM o ) es el promedio ponderado de las masas de un elemento isótopos en comparación con ![]() la masa de un átomo de carbono-12.
la masa de un átomo de carbono-12.
Todos los elementos tienen isótopos, pero algunos isótopos son más abundantes que otros. En un tabla periódica, el número que vemos para la masa atómica relativa de un átomo es un promedio de las masas de los isótopos de un elemento Este promedio incluye un porcentaje de la frecuencia con la que se presenta un isótopo en la naturaleza. Esto se llama el porcentaje de abundancia .
Ejemplo
El cloro tiene dos isótopos: cloro-35 y cloro-37. Una cuarta parte del cloro que se encuentra en la naturaleza es cloro-37 y las tres cuartas partes son cloro-35.
Puedes calcular la masa atómica relativa usando esta fórmula:
Ar = suma de masa isotópica x abundancia isotópica / 100
Entonces, la masa atómica relativa del cloro sería:
= (35 × 75) + (37 × 25) ÷ 100
= (2625 + 925) ÷ 100 = 35,5
En la tabla periódica, el número de masa atómica relativa es el promedio ponderado de todas las masas de los isótopos de un elemento

Sobre la tabla periódica, el número de masa atómica relativa es el promedio ponderado de todas las masas de los isótopos de un elemento. Olive [Odagbu], Originales de StudySmarter
Cuando decimos ‘ promedio ponderado ‘ , queremos decir que tiene en cuenta las masas de todos los isótopos de ese elemento.
¿Qué es la masa molecular relativa?
El promedio ponderado de la masa de una molécula en relación con el 112 de la masa de un átomo de carbono-12 se denomina masa molecular relativa (Mr o RMM).
Debemos decir ‘promedio ponderado’ cuando hablamos de RMM. Como ejemplo, veamos la molécula ![]() .
.
Una muestra promedio de ![]() moléculas tendrá átomos de cloro-37 y cloro-35. Esto significa que las masas de las moléculas variarán, así:
moléculas tendrá átomos de cloro-37 y cloro-35. Esto significa que las masas de las moléculas variarán, así:
Una 12 + 1 + (3×35) = 118
Dos 12 + 1 + (2×35) + 37 = 120
12 + 1 + 35 + (2×37) = 122
12 + 1 + (3×37) = 124
Entonces, un promedio ponderado incluye cuántas de cada una (o la abundancia) de estas moléculas encontramos en una muestra promedio de una sustancia. Calculamos la abundancia de un isótopo como un porcentaje.
La masa molecular relativa se refiere a moléculas con un número fijo de átomos unidos por enlaces covalentes. unión, incluidos los gases nobles. No incluye cosas unidas iónicamente como el cloruro de sodio (NaCl).
Ejemplo
Podemos calcular Mr sumando las masas relativas de los átomos en una molécula. Por ejemplo, la molécula (de agua) tiene dos átomos de hidrógeno y un átomo de oxígeno. Puedes calcular su masa molecular así:

masa atómica de hidrógeno = 1
masa atómica de oxígeno = 16
Señor de H2O
La primera = (2×1) + (1×16)
= 2 + 16
= 18
No tiene unidad porque medimos las masas comparándolas con la masa del carbono-12. El valor que calculamos no es la masa real de un átomo sino una medida comparativa .
¿Qué es la masa fórmula relativa?
La masa fórmula relativa es otra forma de medir la masa de un compuesto. Utiliza el mismo símbolo que la masa molecular relativa: Sr.
Definición de Masa relativa
La masa relativa de fórmula (![]() ) es el promedio ponderado de las masas de una unidad de fórmula en comparación con
) es el promedio ponderado de las masas de una unidad de fórmula en comparación con ![]() la masa de un átomo de carbono-12.
la masa de un átomo de carbono-12.
Una unidad de fórmula es la fórmula empírica o la fórmula más simple de una sustancia química.
Al calcular Se, debe usar la fórmula empírica del químico.

Podemos usar la fórmula relativa masa para encontrar la masa tanto de las sustancias unidas covalentemente como de las unidas iónicamente .
Los científicos usan ‘ masa fórmula relativa ‘ en lugar de ‘ masa molecular relativa ‘ para evitar sugerir que los compuestos iónicos y los iones son moléculas.
¿Qué es un ion?
Cuando un átomo tiene más electrones o menos electrones que protones, lo llamamos ion . Los iones tienen cargas positivas o negativas.
Un ion con más electrones que protones tiene carga negativa , mientras que un ion con menos electrones que protones tiene carga positiva .

¿Cómo calculamos la masa fórmula relativa?
Puede encontrar la masa fórmula relativa de un compuesto sumando las masas atómicas relativas de los átomos que contiene.
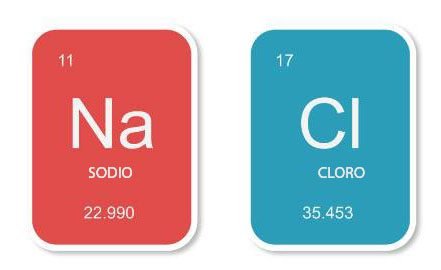
= 23 + 35,5
= 58,5
Masa atómica relativa: puntos clave
- La masa relativa es la masa de un átomo o molécula comparada con la de 1/12 de un átomo de carbono-12.
- La masa atómica relativa (Ar) es el promedio ponderado de las masas de los isótopos de un elemento en comparación con 1/12 de la masa del átomo de carbono-12.
- La fórmula para la masa atómica relativa es ∑ masa isotópica x abundancia isotópica / 100.
- La masa molecular relativa (Mr) es el promedio ponderado de la masa de una molécula comparada con 1/12 de la masa del átomo de carbono-12. Lo usa solo cuando habla de compuestos covalentes.
- La masa fórmula relativa (Mr) es lo mismo que la masa molecular relativa. Puedes usarlo para hablar de compuestos covalentes e iónicos.
Preguntas frecuentes sobre la masa atómica relativa
¿Qué es un número atómico?
Llamamos número atómico al número de protones en un átomo de un elemento. Los números atómicos pueden ayudarte a identificar un elemento. Por ejemplo, si encuentra que un átomo tiene un número atómico de ocho, puede concluir que es un átomo de oxígeno. ¡Entonces todos los isótopos de un elemento tienen el mismo número atómico!
¿Cuál es la masa relativa de un electrón?
Un electrón pesa 9,11 x 10^-28 gramos. ¡Eso es 1/2000 de la masa de un protón!
¿Cuál es la masa relativa de un neutrón?
Un neutrón pesa 1,68 x 10^-24 gramos. Podemos decir que los neutrones tienen una masa de una unidad de masa atómica unificada (o 1u), aproximadamente.
¿Cómo se calcula la masa fórmula relativa?
Puede encontrar la masa fórmula relativa de un compuesto sumando las masas atómicas relativas de los átomos que contiene. Como ejemplo, la masa fórmula de NaCl es 58,5. (Sr de sodio = 22,99; Sr de cloro = 35,45.)
▶️ Índice:




