Isótopos: Los átomos son pequeños, muy pequeños. Imagina una toronja, con todos sus átomos como átomos de nitrógeno.
¿Qué es Isótopos?
Si tuvieras que hacer estallar la toronja para que fuera del tamaño de la Tierra, ¿Qué tamaño crees que tendría cada uno de los átomos? ¿El tamaño del Reino Unido? ¿Un campo de fútbol? ¿Un taxi de Londres? Solo serían del tamaño de un arándano.
Puedes imaginar que esto hace que descubrir algunas de las propiedades más simples de un átomo, como su masa, sea un poco difícil. Para representar la masa, usamos algo llamado número de masa , un valor que es particularmente importante cuando observamos isótopos.
Lo que encontrarás en este artículo
- El número de partículas fundamentales en un átomo.
- ¿Qué es un isótopo?
- ¿Qué es la masa atómica relativa?
- Isótopos: conclusiones clave
- Preguntas frecuentes sobre isótopos
- Cuestionario final de isótopos
Definición de masa de un átomo
El número de masa de un átomo, también conocido como A, es el número total combinado de protones y neutrones en su núcleo.
Recordarás de “Partículas fundamentales” que los átomos tienen tres partículas subatómicas principales . De hecho, tienen algunos más que eso, pero en este momento solo nos preocupamos por el protón , el neutrón y el electrón.
También puede recordar que mientras que los protones y los neutrones tienen masas muy similares, la masa de un electrón es casi inexistente . Entonces, al calcular la masa de un átomo, podemos ignorar su número de electrones. La siguiente tabla le da un recordatorio de las masas y cargas relativas de los tres partículas fundamentales:

Pero conocer el número de masa de un átomo no es muy útil, ya que podría contener múltiples combinaciones diferentes de protones y neutrones. Por ejemplo, tome un átomo con un número de masa de 14. ¿Tiene ocho protones y seis neutrones, o seis protones y ocho neutrones, o tal vez siete de cada uno? Aquí es donde el número atómico es útil.
Definición de número atómico
El número atómico de un átomo , Z , es simplemente el número de protones en su núcleo.
El número atómico también nos dice exactamente qué elemento en el tabla periódica es una parte de, ya que todos los átomos en un elemento tienen el mismo número de protones.
Importante
¿Por qué usamos la letra A para representar el número de masa y la letra Z para representar el número atómico? Bueno, A proviene de la palabra alemana Atomgewicht , que significa peso del átomo, mientras que Z proviene de la palabra alemana Zahl , que significa número.
El número de partículas fundamentales en un átomo.
Para saber exactamente cuántos protones, neutrones y electrones contiene un átomo, necesitas saber su número de masa y número atómico. Pero por suerte tu – el tabla periódica le da esta información de forma gratuita! Tomemos el carbono como ejemplo.

El número mayor, 12, es su número másico y el menor, 6, es su número atómico. ¿Qué podemos aprender de esto? Bueno, debido a que su número atómico es 6, el carbono debe tener seis protones.
Los átomos neutros contienen la misma cantidad de electrones que los protones, lo que significa que el carbono también tiene seis electrones.
Recordarás que el número de masa es simplemente el número de protones y neutrones combinados, así que para encontrar el número de neutrones podemos restar el número de protones, el número atómico, del número de masa. Aquí, 12 – 6 = 6. Este átomo de carbono tiene seis neutrones.
También podríamos mostrar el número másico y el número atómico escribiendo ![]()
Veamos otro ejemplo.
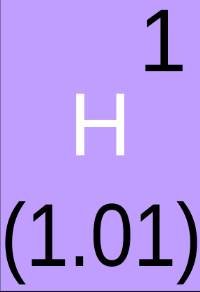
Aquí, el hidrógeno tiene un número de masa de 1 pero también un número atómico de 1, al número entero más cercano. Por lo tanto, debe tener un protón y un electrón. 1 – 1 = 0, por lo que no tiene neutrones.
¿Qué es un isótopo?
Notarás que el número de masa del hidrógeno no es un número entero. De hecho, casi ninguno de los números de masa en la tabla periódica son. ¿Por qué es este el caso? Bueno, los números de masa dan cuenta de los isótopos de un elemento. Exploraremos lo que eso significa a continuación, pero por ahora, echemos un vistazo a qué es exactamente un isótopo.
Definición de Isótopo
Los isótopos son átomos de un mismo elemento con el mismo número de protones y electrones pero distinto número de neutrones.
Esto significa que los isótopos tienen diferentes pesos atómicos y números másicos pero el mismo número atómico . Los isótopos ocurren naturalmente debido a las diferentes estabilidades de los diferentes arreglos de protones y neutrones en el núcleo.
Los isótopos de un mismo elemento tienen las mismas propiedades químicas ya que tienen las mismas configuración electrónica. Sin embargo, tienen diferentes propiedades físicas porque tienen masas diferentes. Representamos los isótopos por un pequeño número de masa en superíndice a la izquierda del símbolo químico. Por ejemplo, ![]() tiene una masa atómica de 12 pero
tiene una masa atómica de 12 pero ![]() tiene una masa atómica de 13, lo que significa que contiene un neutrón adicional.
tiene una masa atómica de 13, lo que significa que contiene un neutrón adicional.
Isótopos de hidrógeno
El hidrógeno tiene tres isótopos naturales:
 Conocido simplemente como hidrógeno , es el isótopo más abundante de hidrógeno. Cada átomo tiene un protón, un electrón y ningún neutrón.
Conocido simplemente como hidrógeno , es el isótopo más abundante de hidrógeno. Cada átomo tiene un protón, un electrón y ningún neutrón. También conocido como deuterio , tiene el mismo número de protones y electrones que el hidrógeno pero tiene un neutrón.
También conocido como deuterio , tiene el mismo número de protones y electrones que el hidrógeno pero tiene un neutrón. También conocido como tritio , también tiene un protón y un electrón pero tiene dos neutrones.
También conocido como tritio , también tiene un protón y un electrón pero tiene dos neutrones.
Radioactividad
El número de neutrones en un átomo está determinado por la estabilidad relativa del núcleo . Los elementos más ligeros, como el carbono, son más estables cuando tienen el mismo número de protones y neutrones en sus núcleos, mientras que los elementos más pesados prefieren tener un poco más de neutrones.
Esto mantiene sus núcleos estables. Los átomos con demasiados o muy pocos neutrones existen en la naturaleza, pero a menudo son inestables. Esto significa que se descompondrán y liberarán radiación. A estos átomos los llamamos isótopos radiactivos .
Para volverse más estables, pueden emitir una partícula alfa , que es un paquete de dos protones y dos neutrones, o una partícula beta ., que es un electrón que se mueve rápidamente. Esto ocurre si un neutrón se convierte en un protón y un electrón. Ambos tipos de desintegración radiactiva cambian la relación entre el número de masa y el número atómico del átomo, haciéndolo más estable.
¿Qué es un ion?
Sabemos que todos los átomos de un elemento tienen el mismo número de protones y acabamos de aprender que pueden tener diferente número de neutrones. Pero, ¿qué sucede si tienen diferente número de electrones?
Definición de un Ion
Un ion es un átomo que ha ganado o perdido uno o más electrones para formar una partícula cargada.
Sin embargo, los iones todavía tienen el mismo número de protones, por lo que el mismo número atómico. Un ion negativo ha ganado electrones mientras que un ion positivo ha perdido electrones, ya que los electrones tienen carga negativa.
Los iones de un mismo elemento tienen propiedades químicas diferentes porque tienen configuraciones electrónicas diferentes. Los átomos tienden a querer tener una capa externa completa de electrones, por lo que su número de electrones puede cambiar drásticamente su reactividad. Por ejemplo, no encontrará átomos de sodio en ningún lugar de la naturaleza, pero encontrará iones de sodio positivos, nortea+![]() Esto se debe a que los átomos de sodio reaccionan fácilmente para perder dos electrones y así tener una capa exterior completa.
Esto se debe a que los átomos de sodio reaccionan fácilmente para perder dos electrones y así tener una capa exterior completa.
Los iones están representados por un pequeño número en superíndice a la derecha del símbolo químico que muestra la carga del ion, o por números romanos. Por ejemplo, ![]() ha perdido 3 electrones del átomo de Fe neutro para formar un ion positivo con una carga de +3. Esto también puede estar representado por el hierro (III).
ha perdido 3 electrones del átomo de Fe neutro para formar un ion positivo con una carga de +3. Esto también puede estar representado por el hierro (III).
Tomemos el ion de litio ![]() como ejemplo. El litio tiene un número atómico de 3 y por lo tanto tiene tres protones. Si se tratara de un átomo sin carga, también esperaríamos que tuviera tres electrones. Sin embargo, este ion tiene carga positiva, lo que significa que ha perdido un electrón. Por lo tanto,
como ejemplo. El litio tiene un número atómico de 3 y por lo tanto tiene tres protones. Si se tratara de un átomo sin carga, también esperaríamos que tuviera tres electrones. Sin embargo, este ion tiene carga positiva, lo que significa que ha perdido un electrón. Por lo tanto, ![]() tiene sólo dos electrones.
tiene sólo dos electrones.
¿Qué es la masa atómica relativa?
Entonces, ¿por qué los números de masa de los elementos no son números enteros? Bueno, esto se debe a que los números de masa en el tabla periódica usar Masa atómica relativa.
Definición masa atómica relativa
La masa atómica relativa es la masa promedio de un átomo de un elemento en una muestra en comparación con 1/12 de la masa de un átomo de ¹²C, teniendo en cuenta la abundancia de diferentes isótopos.
Medimos Masa atómica relativa en la escala de carbono-12 , donde ¹²C tiene una masa de exactamente 12.
Para calcular la masa atómica relativa de una muestra, represente el porcentaje de abundancia de cada isótopo como un decimal. Multiplícalo por la masa del isótopo y suma todos los valores. Esta es su masa atómica relativa.
Por ejemplo, una muestra de cloro puede contener ![]()
0,75 x 35 = 26,25
0,25 x 37 = 9,25
26,25 + 9,25 = 35,5
Por lo tanto, la masa atómica relativa del cloro es 35,5.
Isótopos: conclusiones clave
- El número atómico de un átomo, Z, es el número de protones en su núcleo. Su número de masa, A, es su número total combinado de protones y neutrones.
- Los isótopos de un elemento contienen diferentes cantidades de neutrones, mientras que los iones contienen diferentes cantidades de electrones.
- La masa atómica relativa se puede calcular utilizando la abundancia relativa de isótopos.
Preguntas frecuentes sobre isótopos
¿Qué es un isótopo?
Los isótopos son átomos de un mismo elemento con diferente masa atómica. Esto se debe a que tienen diferente número de neutrones.
¿Todos los isótopos son radiactivos?
Para calcular la masa atómica relativa, primero convierta el % de abundancia de cada isótopo en un decimal. Luego, multiplique cada decimal por la masa de su isótopo respectivo y sume todos estos valores.
¿Cuántos isótopos de hidrógeno hay?
Hay tres isótopos de hidrógeno: hidrógeno, deuterio y tritio.
¿Cuál es la vida media de un isótopo radiactivo?
La vida media de un isótopo radiactivo es el tiempo que tarda en desintegrarse la mitad de los átomos radiactivos presentes en una muestra.
¿Qué es el número másico de un elemento?
El número total combinado de protones y neutrones en su núcleo.
¿Qué es el número atómico de un elemento?
El número de protones en su núcleo.
¿Qué símbolo representa el número de masa?
A
¿Qué símbolo representa el número atómico?
Z
Un átomo tiene ocho protones. ¿Cuántos electrones tiene?
8
Un átomo tiene seis protones. ¿Cuántos neutrones tiene?
5
¿Qué es un ion?
Un átomo que ha ganado o perdido un electrón para formar una partícula cargada.
¿En qué se diferencian los isótopos de un mismo elemento?
Los isótopos de un mismo elemento tienen el mismo número de protones y electrones pero diferente número de neutrones.
Compara iones e isótopos.
- Los iones e isótopos de un mismo elemento tienen el mismo número de protones.
- Los isótopos tendrán diferentes cantidades de neutrones pero la misma cantidad de electrones, mientras que los iones tienen diferentes cantidades de electrones.
- Los isótopos son neutros en general, mientras que los iones son partículas cargadas.
El aluminio puede formar un ion con una carga de +3. Representa esto usando números romanos.
Al (III)
El berilio puede reaccionar para formar un ion al perder dos electrones. ¿Cuál es la carga de este ion?
2+
Definir masa atómica relativa.
La masa promedio de un átomo de un elemento en una muestra comparada con 1/12 de la masa de un átomo de ¹²C.
Calcular la masa atómica relativa de una muestra de cobre que contiene 69% 63Cu y 31% 65Cu, con 1 decimal.
63.6
▶️ Índice: