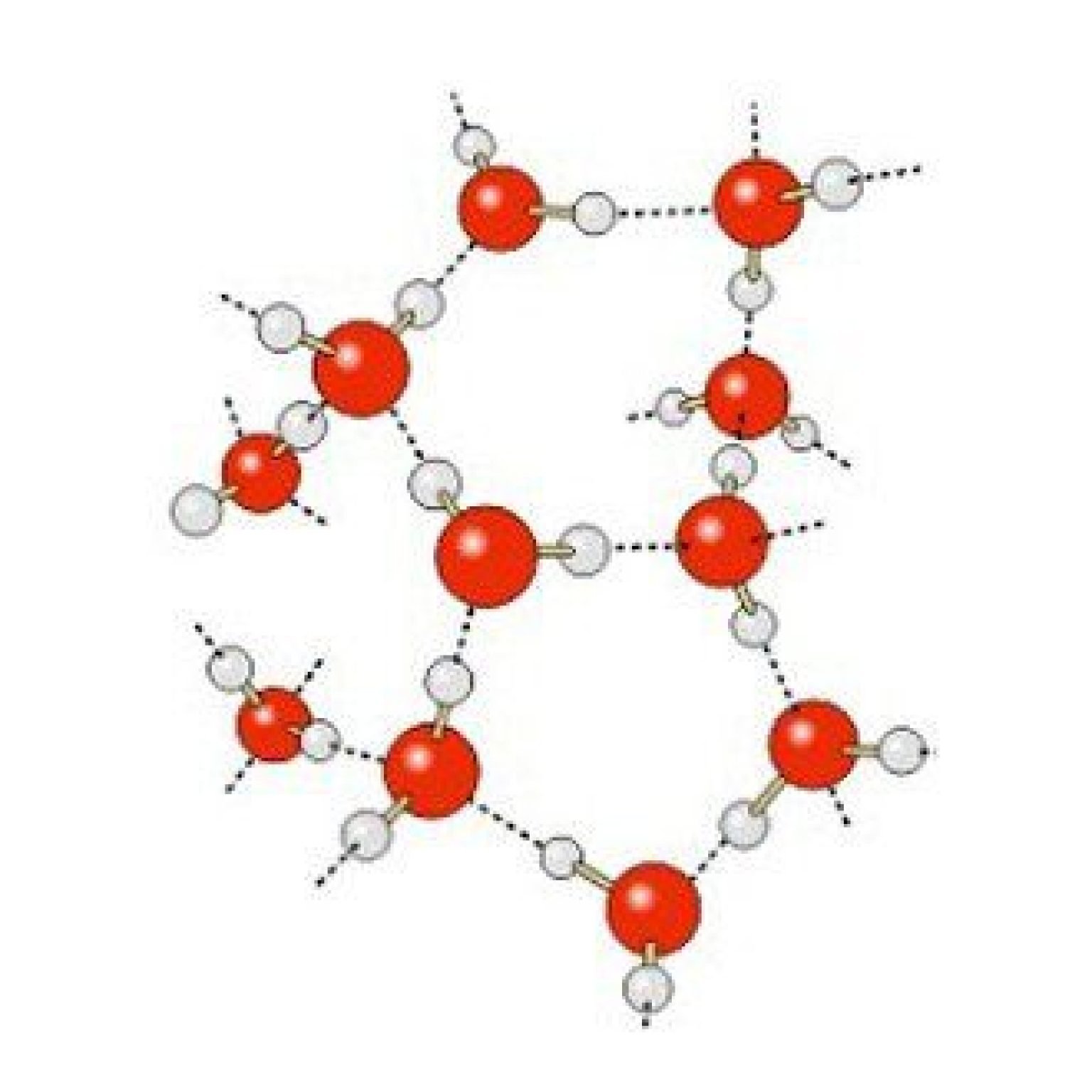
Enlace químico: Es el responsable de las atractivas interacciones entre todos los atomos y las moléculas.
Los Enlace químico pueden sufrir roturas bajo ciertos aspectos determinantes
En esta entrega, conocerás todo lo relacionado con un enlace químico y la clasificación de la misma. Al igual que ejemplos de enlaces iónicos, covalentes y metálicos.
Definición de Enlace químico
Consiste en la fuerza que emplea para que los átomos puedan unirse y dar lugar a los compuestos químicos. Esta combinación les proporciona estabilidad al compuesto surgido, al igual que la energía requerida para quebrar un enlace químico y esto recibe el nombre de energía de enlace.
Durante este proceso, los átomos comparten electrones de la capa de valencia (es una capa que se encuentra por fuera de un átomo en donde se establece su reactividad en la creación de enlaces), y se mezclan estableciendo nuevas sustancias homogéneas (no uniones), indivisibles por medio de mecanismos físicos como el tamizado o el filtrado.
Los enlaces químicos son fundamentales para la existencia de organismos vivos – Enlace químico
Es un hecho que los átomos producen materia y tienden a combinarse por medio de varios métodos que comparten y equilibran sus cargas eléctricas naturales, esto con la finalidad de conseguir una mayor estabilidad que cuando se encuentran separados.
Cabe señalar, que los enlaces químicos establecen la creación de moléculas orgánicas e inorgánicas, y por ende, es la base fundamental de que los organismos vivos existan. No está demás añadir que, los enlaces químicos pueden quebrarse bajo algunas condiciones.
Tipos de Enlace químico
Las temperaturas elevadas son un factor clave para que el enlace químico se quiebre
Y esta acción puede suceder si los componentes químicos son sometidos a altas temperaturas empleando electricidad o motivando a reacciones químicas con otros elementos. Poniendo como ejemplo, si empleamos electricidad al agua, se va a producir la separación de las combinaciones químicas entre el oxígeno y el hidrógeno que la componen, y este procedimiento recibe el nombre de electrólisis.
Para una mayor aclaración citamos otro ejemplo, el cual se trata de agregar una gran cantidad de calor (energía calórica) en una proteína, lo que provocaría que la misma se desnaturalice (perdida de la estructura secundaria de una proteína) o quebrar todos sus enlaces.
Clasificación de Enlace químico
- Enlace metálico:
Esto se produce solamente entre átomos metálicos de una misma clase de componente, que generalmente establecen estructuras rígidas y fuertes, sumamente macizas. Es un enlace resistente, que mezcla los núcleos atómicos entre sí, envueltos por electrones como si estuviera en una nube.
- Enlace covalente:
Es característico de los átomos no metálicos, la misma comparte sus electrones al momento de combinarse, que corresponden a su capa de valencia, y esta clase de enlaces son las que predominan en las moléculas orgánicas y estas se dividen en tres: las cuales son, simple (A-A), doble (A=A) y triple (A≡A), siempre y cuando se tenga en cuenta la cantidad de electrones compartidos.
- Enlace iónico:
Está basado en la atracción electrostática que se da entre partículas que constan de cargas eléctricas pero con signos contrarios denominadas iones (son partículas que contienen electricidad, y puede ser un átomo o molécula que ha adquirido o perdido electrones, o sea que no es neutral).
Muestras de Enlace químico
Ejemplos de enlaces iónicos:
- Óxido de magnesio (MgO)
- Sulfato de cobre (CuSO4)
- Loduro de potasio (KI)
- Cloruro de manganeso (MnCl2)
- Carbonato de calcio (CaCO3)
- Sulfuro de hierro (Fe2S3)
Ejemplos de enlaces metálicos – Enlace químico
- Barras de hierro (Fe)
- Yacimientos de cobre (Cu)
- Barras de oro puro (Au)
- Barras de plata pura (Ag).
También te puede Interesar: Enlace Iónico: Concepto, Caracteristicas, ejemplos y más
Ejemplos de enlaces covalentes – Enlace químico
- Benceno (C6H6)
- Metano (CH4)
- Glucosa (C6H12O6)
- Amoníaco (NH3)
- Freón (CFC)
- En todas las representaciones del carbono (C): grafeno, diamantes, entre otros.
▶️ Índice: