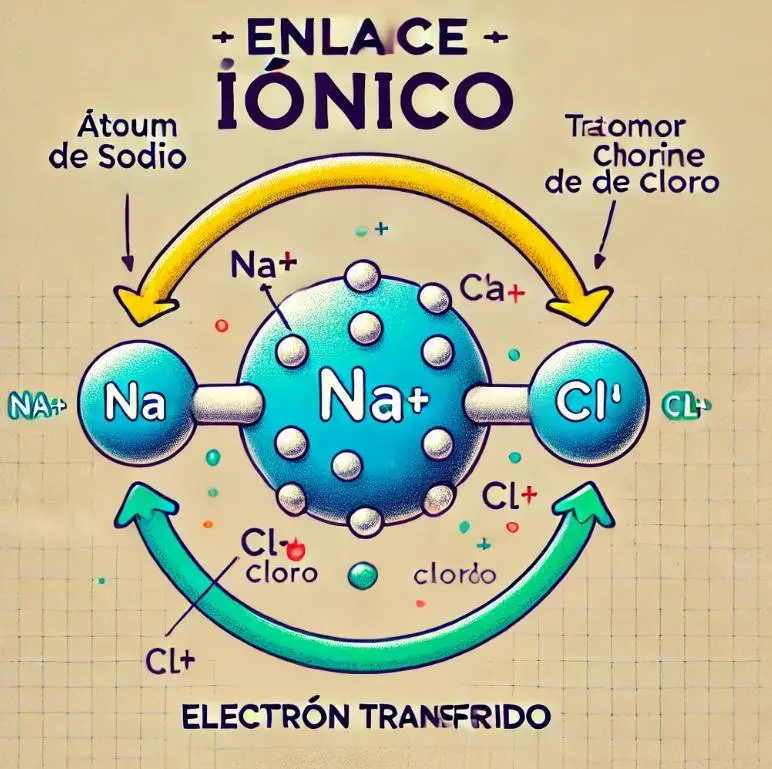
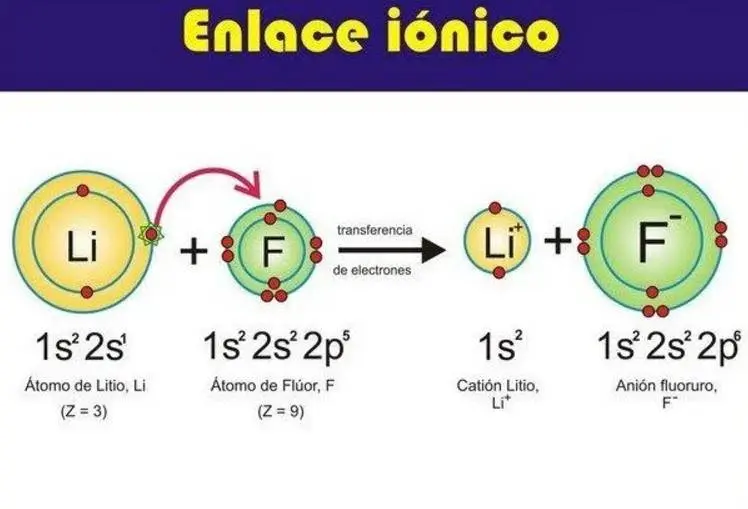
Enlace Iónico: El enlace iónico se encuentra basado en la atracción electrostática que se produce entre partículas que poseen cargas eléctricas con signos contrarios que reciben el nombre de iones.
🤔 Concepto de enlace iónico o electrovalente
Un ion es una partícula que cuenta con carga eléctrica, y puede tratarse de una molécula o de un átomo, que adquirió o perdió electrones, en pocas palabras, no es neutro.
👉 Se presentan en los átomos metales y no metales
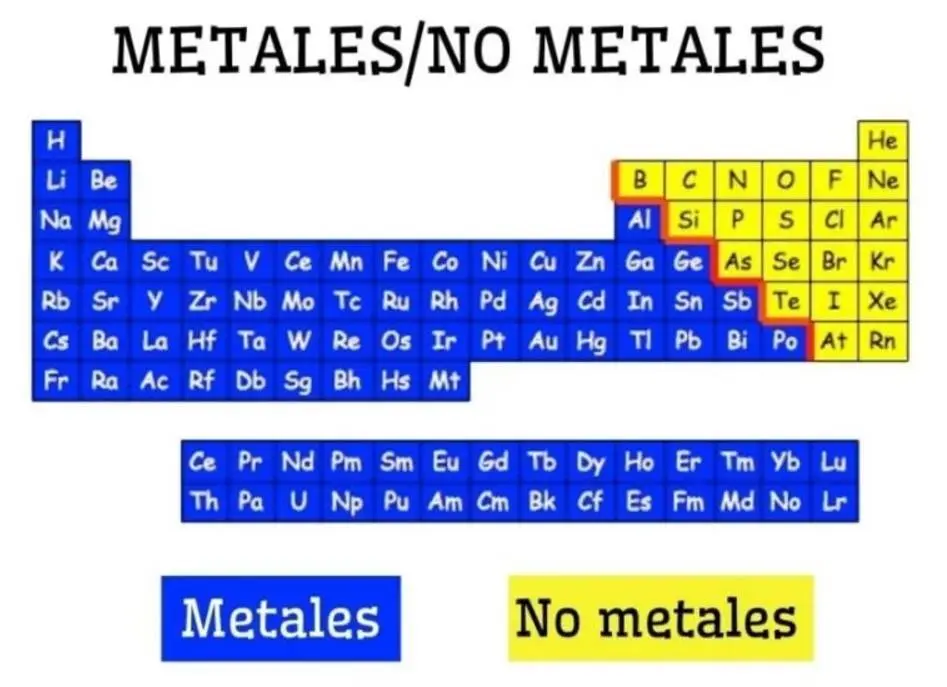
Generalmente, este tipo de enlaces se presenta en átomos metálicos y no metálicos, en donde la transferencia de los electrones sucede desde los átomos metálicos (menor electronegativos) con dirección a los no metálicos (mayor electronegativos).
Para que un enlace iónico pueda formarse requiere que la diferencia de electronegatividad (es la capacidad que posee un átomo para atraer electrones de otro átomo cuando estas funcionan en un enlace químico) de los dos átomos sea mayor o igual a 1,7 en la escala de Pauling, el cual es utilizado para que los átomos sean clasificados de acuerdo a su valor electronegativo.
👉 No existen iones totalmente puros
En muchas ocasiones, el enlace iónico puede ser diferenciada del covalente (se basa en el compartimiento de átomos que corresponde a la capa externa de los dos átomos), a decir verdad, no hay un enlace iónico que sea totalmente puro, porque este modelo es sindicado como una hipérbole del enlace covalente, con gran utilidad para el análisis y la investigación acerca del comportamiento atómico en este tipo de situaciones.
🤔 ¿Que es un enlace iónico?
✍️ Los iones no disponen de polos positivos ni negativos – Enlace Iónico
No obstante, lo que la hace diferente de los átomos que componen los enlaces covalentes es que normalmente establecen moléculas polares, en cambio, los iones no constan de un polo positivo o negativo, ya que ellos solamente habita una sola carga.
Los cationes se producen cuando un átomo pierde electrones, quedándose con carga positiva, y los aniones, cuando el átomo adquiere electrones, obteniendo así carga negativa.
✍️ Características de las composiciones iónicas – Enlace Iónico
- Enlaces fuertes:
La fuerza que posee esta combinación puede llegar a ser muy intensa, lo cual hace que la estructura de esta composición produzca redes cristalinas muy rígidas.
- Solidez:
Bajo temperaturas y rangos de presión habitual (T= 25°C y P= 1atm), estas composiciones constan con una estructura molecular resistente y con forma cúbica, componiendo redes cristalinas que originan sales. Igualmente, hay líquidos iónicos llamados “sales derretidas”, que no son muy habituales, pero son demasiado útiles.
- Selectivo:
Los enlaces iónicos solamente pueden valerse de los metales que se encuentran en las agrupaciones IA y IIA que se hallan en la Tabla Periódica, no así en los no metales del grupo VIA y VIIA.
- Soluble en el agua:
Las sales por lo general se disuelven en el agua y las demás soluciones acuosas que exponen un dipolo eléctrico (polos positivo y negativo).
🤔 ¿Cómo se forma un Enlace Iónico ejemplos?
Consta de un punto elevado de combinación y ebullición: – Enlace Iónico
Su punto de combinación y de ebullición de estas composiciones son demasiado elevadas (rondan por los 300°C y 1000°C), esto se debe a que se necesita de mucha energía para que la atracción electrostática entre los iones sea quebrada.
- Conducción eléctrica:
Cuando se presentan es su estado sólido, no son los ideales para la conducción eléctrica, a causa de que los iones tienen sus posiciones concretas en una red cristalina. No obstante, cuando la misma se encuentra disuelta en el agua, se presentan con mayor eficacia para la conducción de electricidad.
También te puede Interesar: Enlace covalente: Ejemplos de Enlaces, Composición y más
👉 Enlace iónico y sus ejemplos – Enlace Iónico
- Fluoruros (F–):
Aniones que están involucrados en la obtención de sales empezando por el ácido fluorhídrico (HF). La misma es utilizada para la producción de pastas dentales y otros elementos para el campo odontológico.
Muestra: NaF, KF, CaF2 , LiF
- Sulfatos (SO42-):
Estos aniones son parte de las sale si ésteres que se obtienen por medio del ácido sulfúrico (H2SO4), que cuando se une a un metal adquiere diversas aplicaciones, tales como materiales de obras e insumos para radiografías de contraste.
Muestra: CuSO4, CaSO4, K2SO4
Nitratos (NO3–):
Aniones involucrados en la adquisición de sales o ésteres por medio del ácido nítrico (HNO3), utilizados en la producción manual de pólvora y en abonos o fertilizaciones.
Muestra: AgNO3, KNO3, Mg(NO3)2
- Mercurio II (Hg2+):
Un catión que se adquiere del mercurio, denominado como catión mercúrico y que nada más puede situarse de forma estable en medios de pH ácido (<2). Los componentes del mercurio son tóxicos para el ser humano, por ende, debe ser tratado con cuidado.
Muestra: HgCl2, HgCN2
- Permanganatos (MnO4–):
Las sales del ácido permangánico (HMnO4) cuentan con un color púrpura muy intenso y con una gran capacidad oxidante.
Las propiedades son útiles en la síntesis de la sacarina, en la producción de desinfectantes y al momento de tratar las aguas residuales.Muestra: KMnO4, Ca(MnO4)2
▶️ Índice: