Enlace covalente: Un enlace covalente surge de la formación de átomos que no manifiestan un diferencia significativa de electronegatividad
🤔 ¿De donde surge un Enlace covalente?
Un enlace covalente surge de la formación de átomos que no manifiestan un diferencia significativa de electronegatividad
Se denomina enlace covalente a un tipo de enlace químico qué sucede cuando dos átomos se combinan para dar surgimiento a una molécula, comparten electrones que corresponden a su capa de valencia o último nivel energético, y por medio de eso pudieron alcanzar el reconocido “octeto estable”, conforma a la “regla del octeto” planteado por Gilbert Newton Lewis, que se encuentra basado en la estabilidad electrónica de los átomos.
🤔 ¿Qué plantea la regla del octeto?
La misma propone que los iones pertenecientes a la Tabla Periódica, puedan completar lo que falta de sus niveles de energía con 8 electrones, y este sistema electrónico les brinda una mayor estabilidad, el cual es muy parecido a la de los gases nobles.
Los átomos combinados por medio de los enlaces covalentes comparten más de un electrón que corresponde a su último nivel de energía. Recibe el nombre de orbital molecular la zona del espacio en donde se sitúa la densidad electrónica en la molécula.
✍️ La densidad electrónica puede calcularse a base ecuaciones matemáticas
La densidad electrónica puede ser definida y calculada, pero debe realizarse a base de operaciones matemáticas muy complicadas que expresan cómo se comportan los electrones en las moléculas.
Por otra parte, también hay que tener en cuenta que existen los orbitales atómicos, quienes están definidas como la región del espacio que expone la probabilidad de hallar un electrón en las inmediaciones del núcleo atómico. Por ende, cuando se produce la combinación de varios orbitales atómicos, se abre paso a la producción de orbitales moleculares.
🤔 ¿Que es un enlace covalente?
✍️ Los iónicos no comparten electrones
Como citamos con anterioridad, los covalentes surgen de la repartición de electrones entre los átomos que se combinan, y lo que hace distinta de los enlaces iónicos es que en estos últimos mencionados, se produce una transferencia de electrones entre los átomos comprometidos en el enlace iónico (no comparten electrones).
Para que se pueda constituir la formación de un enlace iónico, un átomo tiene que transferir a otro átomo uno o varios electrones, posteriormente este se forma por medio de la interacción electrostática, porque ambos quedan con cargas eléctricas, porque al momento de la transferencia, el átomo proveedor de electrones se queda como catión (carga positiva) y el otro átomo como anión (carga negativa).
✍️ Composición del enlace covalente e iónico
Cabe señalar, que el covalente se constituye entre átomos que presentan una mayor diferencia de electronegatividad. La misma puede estar formada por átomos metálicos, no metálicos e hidrógeno. Con relación al iónico, esta se constituye entre iones que manifiestan una elevada diferencia de electronegatividad, y suele componerse de iones de átomos elementos metálicos y no metálicos.
No está demás aclarar que, no existe ningún tipo de enlace que sea covalente e iónico al cien por ciento, en la mayoría de las veces el enlace iónico es señalado como una “exageración” del covalente.
🤔 ¿Como se forma un enlace covalente?
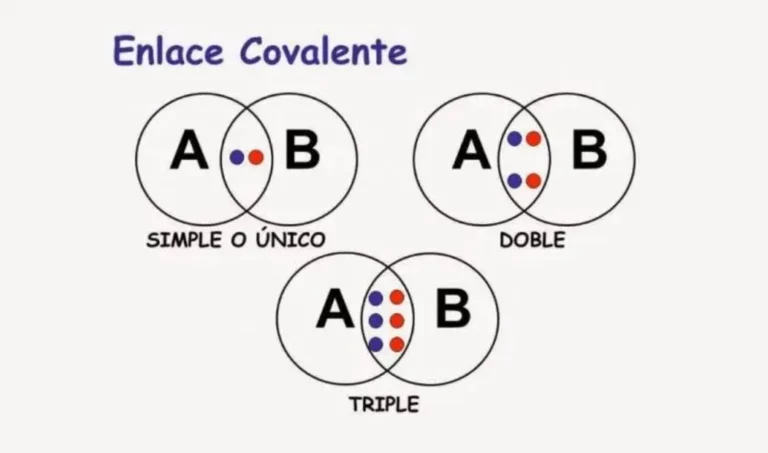
✍️ Clasificación del enlace covalente
- Simple:
La combinación de átomos comparte un electrón por lado, correspondiente a su última capa electrónica. La misma está representada por una línea en la composición molecular.
✍️ Ejemplo:
H-H (Hidrógeno – Hidrógeno)
H-CI (Hidrógeno – Cloro)
- Doble:
Cada átomo involucrado en la combinación, aporta un electrón perteneciente a su última capa de energía, dando lugar al surgimiento de un enlace con dos conjuntos de electrones. Esta se encuentra representada por dos líneas en forma paralela, igual al signo matemático “es igual”.
✍️ Ejemplo:
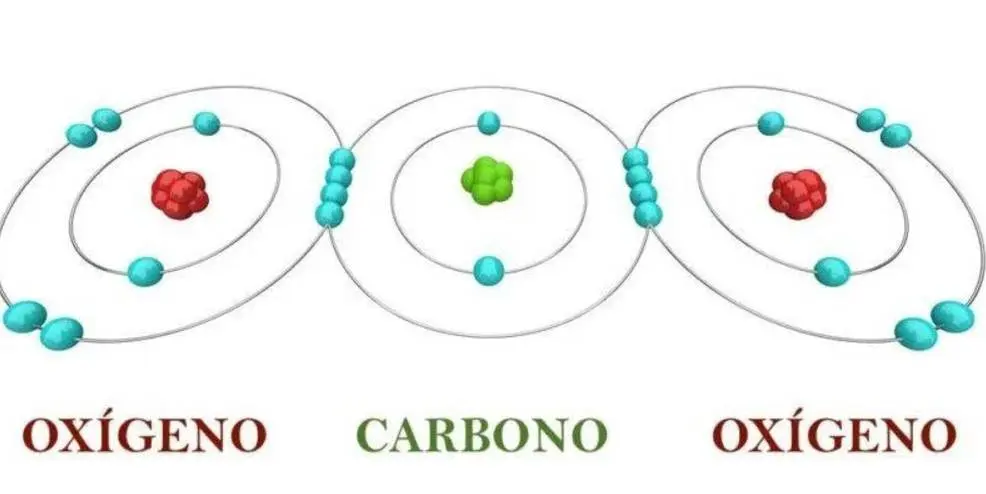
O=O (Oxígeno – Oxígeno)
O=C=O (Oxígeno – Carbono – Oxígeno).
- Triple:
En este punto, en enlace está formado por tres electrones, cada átomo realiza el aporte de realiza el aporte de tres electrones de su última capa energética. La misma se representa por tres líneas en forma paralela.
✍️ Ejemplo:
N ≡ N (Nitrógeno – Nitrógeno).
- Dativo:
En esta clase de enlace covalente, un solo átomo es la que aporta dos electrones, mientras que el otro, ni uno solo.
Su representación de señalarse con una flecha dirigida al compuesto molecular, como lo indica el gráfico:
Igualmente, según la presencia o no de polaridad (propiedad de algunas moléculas que se encargan de alejar la estructura de las cargas eléctricas). También pueden ser distinguidos covalentes polares (crean moléculas polares) y los no polares (crean moléculas no polares):
- Enlaces covalentes polares
Se combinan átomos de diversos componentes y con una diferencia de electronegatividad que se encuentra por encima del 0,5. Mediante esa forma, la molécula podrá adquirir la densidad de carga negativa por encima del átomo electronegativo, a causa de que este átomo puede atraer con más fuerza a los electrones del enlace.
También te puede Interesar: Átomo: Conformación, Fragmentos, Historia y más
Así también, aquel átomo que tenga un electronegativo menor, se verá atribuida con una carga positiva.
- Enlaces covalentes no polares
Los átomos combinados con un mismo componente o varios, pero con electronegatividades parecidas y menor de 0,4. La nube electrónica tiende a ser atraída por los dos núcleos con una intensidad igualitaria y en este caso, no se forma un dipolo molecular como sucede en los covalentes polares.
💪 Unión Covalente – paso a paso
✍️ Ejemplos de los enlaces covalentes
- Oxígeno puro (O2): O=O (doble enlace)
- Hidrogeno puro (H2): H-H (enlace simple)
- Dióxido de carbono: (CO2): O=C=O (cuenta con dos enlaces dobles)
- Agua (H2O): H-O-H (consta de dos enlaces simples)
- Ácido clorhídrico: H-Cl (enlace simple)
- Nitrógeno puro (N2): N≡N (triple enlace)
Ácido cianhídrico (HCN): H-C≡N (un enlace simple y otro de tres)
▶️ Índice: