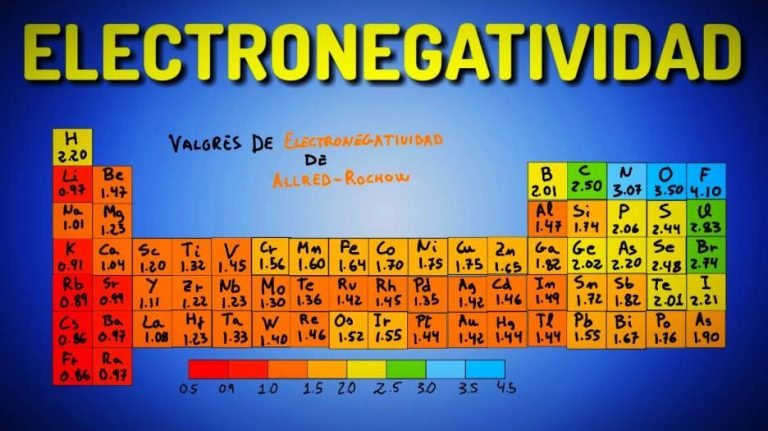
La electronegatividad es la capacidad de un átomo para atraer el par de electrones enlazantes en un enlace covalente a sí mismo. Es por eso que los químicos pueden usar sus valores para predecir si los enlaces entre diferentes tipos de átomos son polares, no polares o iónicos. Muchos factores afectan la electronegatividad dentro de los átomos; también hay tendencias que relacionan los elementos en el tabla periódica a la electronegatividad.
Definición de Electronegatividad
La electronegatividad es el poder y la capacidad de un átomo para atraer y jalar un par de electrones en un enlace covalente hacia sí mismo.
Lo que encontrarás en este artículo
- Este artículo trata sobre la electronegatividad, que viene bajo el enlace en química Física.
- Primero, definiremos la electronegatividad y veremos los factores que la afectan.
- Después de eso, veremos las tendencias de electronegatividad en el tabla periódica.
- Luego, veremos la electronegatividad y el enlace.
- Luego relacionaremos la electronegatividad y la polarización de enlace.
- Finalmente, veremos la fórmula de electronegatividad.
¿Qué factores afectan la electronegatividad?
Veamos algunos factores que afectan la electronegatividad.
1. Radio atómico
La distancia entre los electrones externos en la capa más externa y el núcleo se conoce como radio atómico.
Cuanto menor sea la distancia entre los electrones externos negativos y el núcleo positivo, mayor será la atracción entre ellos. Esto significa que si los electrones están más alejados del núcleo, la atracción será más débil. Por lo tanto, si disminuye el radio atómico, aumenta la electronegatividad.
2. Carga nuclear
La carga nuclear también se conoce como el número de protones en el núcleo. Los electrones con carga negativa y los protones con carga positiva se atraen entre sí.
Debido a esto, si aumenta el número de protones, también aumenta la atracción nuclear hacia los electrones externos.
¡Tener cuidado! No confunda la carga nuclear con un elemento o compuesto que tenga carga.
Blindaje
Si aumenta el número de subcapas y capas internas de un átomo, la electronegatividad disminuye. Esto se debe a que los electrones de las capas internas ‘protegen’ a los electrones externos de la atracción del núcleo, lo que hace que disminuya la atracción entre los electrones externos y el núcleo. Por lo tanto, la adición de subcapas adicionales y capas internas hace que los electrones externos sean menos atraídos por el núcleo.
Tendencias de electronegatividad en la tabla periódica
Veamos algunas tendencias básicas en electronegatividad, que generalmente se cumplen en la tabla periódica.
1. Electronegatividad por un grupo
La electronegatividad disminuye al descender un grupo en la tabla periódica . La carga nuclear aumenta a medida que se agregan protones al núcleo. Sin embargo, el efecto del blindaje también aumenta, ya que hay una capa de electrones extra llena en cada elemento que desciende en un grupo. El radio atómico del átomo aumenta a medida que desciende en el grupo, ya que agrega más capas de electrones, lo que hace que el átomo sea más grande. Esto conduce a un aumento en la distancia entre el núcleo y los electrones más externos, lo que significa que hay una fuerza de atracción más débil entre ellos.
2. Electronegatividad a lo largo de un período
A medida que atraviesa un período en el tabla periódica, aumenta la electronegatividad. La carga nuclear aumenta porque aumenta el número de protones en el núcleo. Sin embargo, el blindaje permanece constante ya que no se agregan nuevas capas a los átomos y se agregan electrones a la misma capa cada vez. Como resultado de esto, el radio atómico disminuye porque la capa más externa se acerca al núcleo, por lo que la distancia entre el núcleo y los electrones más externos disminuye. Esto resulta en una atracción más fuerte para el unión par de electrones.
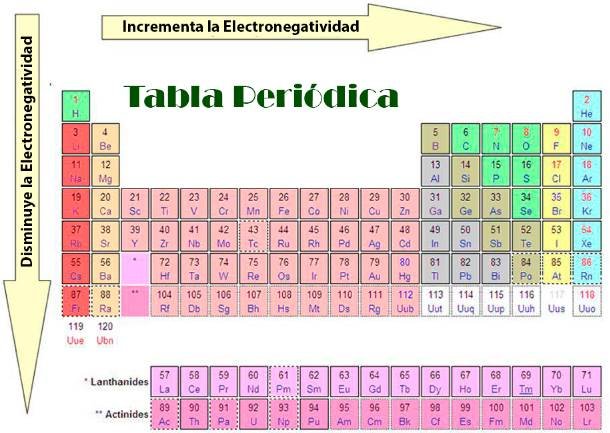
Diagrama que muestra las tendencias de electronegatividad en la tabla periódica. Sahraan Khowaja, StudySmarter Originals
Electronegatividad de los elementos y enlace.
La escala de Pauling es una escala numérica de electronegatividades que se puede utilizar para predecir el porcentaje de carácter iónico o covalente de un enlace químico. La escala de Pauling va de 0 a 4.
halógenos son los elementos más electronegativos de la Tabla periódica, siendo el flúor el elemento más electronegativo de todos, con un valor de 4,0. Los elementos menos electronegativos tienen un valor aproximado de 0,7; estos son el cesio y el francio.
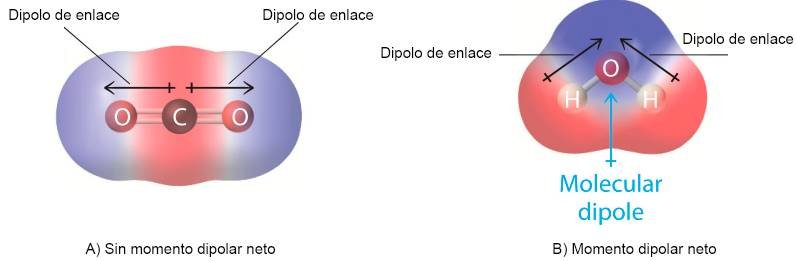
Los enlaces covalentes simples se pueden formar al compartir un par de electrones entre dos átomos.
Ejemplos de moléculas formadas por un solo elemento son los gases diatómicos y moléculas como H 2 , Cl 2 y O 2 . Las moléculas formadas por un solo elemento contienen enlaces que son puramente covalentes. En estas moléculas, la diferencia de electronegatividad es cero ya que ambos átomos tienen el mismo valor de electronegatividad y, por lo tanto, la distribución de la densidad electrónica es igual entre los dos átomos. Esto significa que la atracción hacia la unión par de electrones es igual, resultando en un enlace covalente no polar.
Átomos con diferentes electronegatividades forman una molécula
Sin embargo, cuando átomos con diferentes electronegatividades forman una molécula, la densidad electrónica compartida no se distribuye por igual entre los átomos. Esto resulta en la formación de un polo enlace covalente. En este caso, el átomo más electronegativo (el átomo con mayor valor en la escala de Pauling ) atrae a la unión par de electrones hacia sí mismo. Debido a esto, aparecen cargas parciales en la molécula, ya que el átomo más electronegativo gana una carga negativa parcial, mientras que el átomo menos electronegativo gana una carga positiva parcial.
Un enlace iónico se forma cuando un átomo transfiere completamente sus electrones a otro átomo que gana los electrones. Esto ocurre cuando hay una diferencia lo suficientemente grande entre los valores de electronegatividad de los dos átomos en una molécula; el átomo menos electronegativo transfiere su(s) electrón(es) al átomo más electronegativo. El átomo que pierde su(s) electrón(es) se convierte en un catión, que es una especie con carga positiva, mientras que el átomo que gana el(los) electrón(es) se convierte en un anión, que es una especie con carga negativa. Compuestos como el óxido de magnesio (MgO), el cloruro de sodio (NaCl) y el fluoruro de calcio (CaF 2 ) son ejemplos de esto.
Por lo general, si la diferencia de electronegatividad es mayor que 2,0, es probable que el enlace sea iónico. Si la diferencia es inferior a 0,5, el enlace será enlace covalente no polar. Si hay una diferencia de electronegatividad entre 0,5 y 1,9, entonces el enlace será enlace covalente polar.
| Diferencia en electronegatividad | Tipo de bono |
| >2.0 | iónico |
| 0,5 a 1,9 | covalente polar |
| <0.5 | covalente puro (no polar) |
Es importante recordar que la unión es un espectro , y algunos límites no están bien definidos. Algunas fuentes afirman que un enlace covalente polar es solo hasta 1.6 en la diferencia de electronegatividad. Esto significa que la vinculación debe juzgarse caso por caso en lugar de apegarse siempre a las reglas anteriores.
Ejemplos de Electronegatividad de los elementos
Echemos un vistazo a algunos ejemplos. Tomar LIF:
La diferencia de electronegatividad para esto es 4.0 – 1.0 = 3.0, por lo tanto esto representa un enlace iónico.
AF:
La diferencia de electronegatividad para esto es 4.0 – 2.1 = 1.9, por lo tanto esto representa un enlace covalente polar.
CBr:
La diferencia de electronegatividad para esto es 2.8 – 2.5 = 0.3, por lo tanto esto representa un enlace covalente no polar.
Fórmula de electronegatividad
Como se muestra arriba, uno puede ver todos los valores de electronegatividad de Pauling de los elementos de un dedicado Tabla periódica. Para calcular el bono de polaridad de una molécula, tienes que restar el valor de electronegatividad más pequeño del más grande.
Ejemplo
El carbono tiene un valor de electronegatividad de 2,5 y el cloro tiene un valor de 3,0. Entonces, si tuviéramos que encontrar la electronegatividad del enlace C-Cl, sabríamos la diferencia entre los dos.
Por lo tanto, 3,0 – 2,5 = 0,5.
Electronegatividad y polarización
Si los dos átomos tienen electronegatividades similares, entonces los electrones se encuentran en el medio de los dos núcleos; el enlace será no polar. Por ejemplo, todos los gases diatómicos como H 2 y Cl 2 tienen enlaces covalentes que no son polares ya que las electronegatividades son iguales en los átomos. Por lo tanto, la atracción de electrones a ambos núcleos también es igual.
Sin embargo, si dos átomos tienen electronegatividades diferentes, la unión de los electrones son atraídos hacia el átomo que es más electronegativo. Debido a la distribución desigual de los electrones, se asigna una carga parcial a cada átomo, como se mencionó en el encabezado anterior. Como resultado, el enlace es polar.
Definición de Dipolo
Un dipolo es una diferencia en la distribución de carga entre dos átomos unidos que es causada por un cambio en la densidad de electrones en el enlace. La distribución de la densidad electrónica depende de la electronegatividad de cada átomo.
Se dice que un enlace es más polar si la diferencia de electronegatividad es mayor. Por lo tanto, hay un mayor cambio en la densidad de electrones.
Electronegatividad: Conclusiones claves
- Los factores que afectan la electronegatividad son el radio atómico, la carga nuclear y el blindaje.
- A medida que desciende un grupo en la tabla periódica, la electronegatividad disminuye.
- A medida que atraviesa un período en la tabla periódica, la electronegatividad aumenta.
- La escala de Pauling se puede utilizar para predecir el porcentaje de carácter iónico o covalente de un enlace químico.
- Las moléculas diatómicas tienen una diferencia de cero en electronegatividad, ya que ambos átomos tienen el mismo valor de electronegatividad.
- Cuanto mayor sea la diferencia de electronegatividad de los elementos que forman el enlace, mayor será la posibilidad de que el enlace sea iónico.
- El átomo más electronegativo atrae al unión par de electrones hacia sí mismo.
- Un enlace es no polar si los dos átomos tienen electronegatividades similares.
- Un dipolo es una diferencia de carga entre dos átomos enlazados que es causada por un cambio en la densidad de electrones en el enlace.
- Para calcular la electronegatividad de una molécula hay que restar el valor de electronegatividad más pequeño del más grande.
Preguntas frecuentes sobre electronegatividad
¿Qué es la electronegatividad?
La electronegatividad es el poder y la capacidad de un átomo para atraer y tirar de un par de electrones en un enlace covalente hacia sí mismo.
¿Por qué aumenta la electronegatividad a lo largo de un período?
La carga nuclear aumenta porque aumenta el número de protones en el núcleo. El radio atómico disminuye a medida que disminuye la distancia entre el núcleo y el electrón más externo. El blindaje permanece constante.
¿Cómo afecta una gran diferencia de electronegatividad a las propiedades moleculares?
Cuanto mayor sea la diferencia entre la electronegatividad de los elementos que forman el enlace, mayor será la probabilidad de que el enlace sea iónico.
¿Cuál es la fórmula de la electronegatividad?
Para calcular la polaridad de un enlace en una molécula, debes restar la electronegatividad más pequeña de la más grande.
¿Cuáles son algunos ejemplos de electronegatividad?En una molécula como el cloruro de hidrógeno, el átomo de cloro arrastra los electrones hacia sí mismo porque es el átomo más electronegativo y gana una carga negativa parcial, mientras que el hidrógeno gana una carga positiva parcial.
¿Qué tres factores afectan la electronegatividad?
- Radio atómicoCarga nuclearBlindaje
Explique la tendencia de la electronegatividad al descender en el grupo.
Al descender un grupo en la tabla periódica, la electronegatividad disminuye. La carga nuclear aumenta a medida que se agregan protones al núcleo. Sin embargo, el efecto del blindaje también aumenta, ya que hay una capa de electrones extra llena en cada elemento que desciende en un grupo. El radio atómico del átomo aumenta a medida que desciende en el grupo, ya que agrega más capas de electrones, y esto hace que el átomo sea más grande en tamaño. Esto conduce a un aumento en la distancia entre el núcleo y los electrones más externos, lo que significa que hay una fuerza de atracción más débil entre ellos.
Explicar las tendencias de la electronegatividad a lo largo de un período.
A medida que avanza en un período en la tabla periódica, aumenta la electronegatividad. La carga nuclear aumenta porque aumenta el número de protones en el núcleo. Sin embargo, el blindaje permanece constante ya que no se agregan capas nuevas a los átomos y se agregan electrones a la misma capa cada vez. Como resultado de esto, el radio atómico disminuye porque la capa más externa se acerca al núcleo, por lo que la distancia entre el núcleo y los electrones más externos disminuye. Esto da como resultado una atracción más fuerte para el par de electrones de enlace.
¿Qué es un dipolo?
Un dipolo es una diferencia de carga entre dos átomos enlazados que es causada por un cambio en la densidad de electrones en el enlace.
¿Qué es la escala de Pauling?
La escala de Pauling es una escala numérica de valores de electronegatividad que se puede utilizar para predecir el carácter del enlace (covalente no polar, covalente polar o iónico).
¿Cuál es el elemento más electronegativo de la tabla periódica?
El flúor es el elemento más electronegativo con una electronegatividad de 4.0
¿Cómo calculamos la polaridad de enlace de una molécula?
Para calcular la polaridad de enlace de una molécula, debe restar el valor de electronegatividad más pequeño del más grande.
¿Qué es la densidad electrónica?
La concentración de electrones en una nube de electrones de un átomo.
¿Qué es un enlace covalente polar?
Un enlace covalente polar es aquel en el que los electrones se comparten de manera desigual.
¿Qué es un enlace covalente no polar?
Un enlace covalente no polar es aquel en el que los electrones se comparten por igual.
En términos de electronegatividad, ¿cómo sabemos si es probable que un enlace sea iónico?
Si la diferencia en los valores de electronegatividad es mayor que 2,0, es probable que el enlace sea iónico.
¿Qué elementos son los menos electronegativos?
Los elementos que son menos electronegativos tienen un valor de aproximadamente 0,7 y estos son el cesio y el francio.
¿Cómo podemos predecir si un enlace es no polar?
Si la diferencia en los valores de electronegatividad es inferior a 0,5, entonces el enlace es un enlace covalente no polar.
¿Cómo podemos predecir si un enlace es polar?
Si hay una diferencia de electronegatividad entre 0,5 y 1,9, entonces el enlace es un enlace covalente polar.
▶️ Índice: