Configuración electrónica: Son casi 2000 veces más ligeros que un protón y sólo un tercio del diámetro, pero son extraordinariamente importantes.
Partículas fundamentales
Ah, electrones . Esas diminutas partículas subatómicas, zumbando en sus órbitas. Son casi 2000 veces más ligeros que un protón y sólo un tercio del diámetro, pero son extraordinariamente importantes. recordarás de Partículas fundamentales que mientras el número de protones te dice el elemento del átomo, el número de electrones y su disposición te dan su reactividad y propiedades químicas. ¡Estos son roles importantes para partículas tan pequeñas! Pero, ¿cómo averiguamos la configuración electrónica de un elemento o ion?
Lo que encontrarás en este artículo
- Definición del mismo
- Reglas
- Representando la configuración electrónica
- Elementos
- Configuración electrónica de iones
- Excepciones a la misma
- Evidencia
- Configuración electrónica: puntos clave
- Referencias
- Preguntas frecuentes
- Cuestionario final
Definición de configuración electrónica
La configuración electrónica, es la disposición de los electrones en capas , subcapas y orbitales dentro del átomo.
Si no está familiarizado con los términos anteriores, le recomendamos que consulte Conchas de electrones para aprender un poco más sobre ellos. Por ahora, solo proporcionaremos un breve resumen.
Capas de electrones
Las capas de electrones también se conocen como niveles de energía. Cada capa tiene un número cuántico principal específico. A medida que las capas se alejan del núcleo, su número cuántico principal aumenta y tienen un nivel de energía más alto.
Subcapas de electrones
Las subcapas son divisiones dentro de cada capa. También tienen diferentes niveles de energía: la subcapa s tiene la energía más baja, luego p, luego d, luego f. Cada subcapa contiene diferentes números de orbitales. Por ejemplo, la subcapa s tiene solo un orbital, mientras que las subcapas p tienen tres y las subcapas d tienen cinco.

Orbitales de electrones
Los orbitales son regiones del espacio donde se puede encontrar un electrón el 95 por ciento del tiempo. Cada orbital puede contener como máximo dos electrones . Estos electrones deben tener espines diferentes : uno tiene un espín ascendente y el otro espín descendente. Los orbitales también tienen diferentes formas dependiendo de su subcapa.
Si reunimos todo esto, la configuración electrónica es simplemente cuántos electrones hay en cada orbital atómico y en qué capa y subcapa se encuentran.
Reglas de configuración electrónica
Hay dos reglas principales que debes saber que te ayudarán a determinar la configuración electrónica de un átomo. Estos se conocen como la regla de Hund y el principio de Aufbau . Echaremos un vistazo a ambos antes de ponerlos en práctica con algunos ejemplos.
El principio de Aufbau
En primer lugar, los electrones llenan primero la subcapa con el nivel de energía más bajo. A los átomos les gusta estar en un estado de menor energía y los electrones no son diferentes.
En general, eso significa llenar las conchas con menor capital números cuánticos primero, y dentro del caparazón primero llenando el subcapa s, luego el subcapa p, luego el subcapa d. Pero recuerda la excepción engañosa: ¡3d tiene un nivel de energía más bajo que 4s! Esto significa que se llenará primero. El siguiente diagrama le recuerda los niveles de energía de las diferentes subcapas.

Regla de Hund
Los electrones realmente no se llevan bien entre sí. Tiene sentido: son partículas negativas, por lo que si pones dos juntas, se repelerán entre sí con bastante fuerza. Debido a esto, dentro de las subcapas, los electrones prefieren ocupar su propio orbital si pueden, por lo que primero llenarán un orbital vacío.
Estas dos reglas forman los fundamentos de la configuración electrónica. Pero antes de intentar resolver las configuraciones electrónicas de algunos elementos, primero debemos aprender a representar la configuración electrónica.
Representando la configuración electrónica
Tenemos dos formas diferentes de representar la configuración electrónica:
- Notación estándar.
- Forma de caja.
Representación de la configuración electrónica: notación estándar
La primera forma de representar la configuración electrónica es con notación estándar . Este es quizás el método más fácil; simplemente enumera las subcapas de electrones e indica la cantidad de electrones que contienen con un número en superíndice. Sin embargo, no necesita preocuparse por las subcapas vacías, simplemente puede omitirlas.
Ejemplo
El carbono tiene dos electrones en cada una de las subcapas 1s, 2s y 2p. Escriba su configuración electrónica usando notación estándar.
Esto es bastante simple. Escribimos los nombres de las subcapas en una línea y usamos números en superíndice para mostrar cuántos electrones contienen. En este caso, cada una de las tres subcapas mencionadas tiene solo dos electrones: 1s 2 2s 2 2p 2 .
Al representar las configuraciones electrónicas de elementos más pesados, escribir todas las diferentes subcapas se vuelve bastante agotador.
Hay una forma de evitar esto: si sabe que una especie tiene el mismo electrón que un gas noble, con la adición de unos pocos electrones adicionales, entonces escribe el nombre del gas noble entre corchetes y agrega el electrón adicional sub- conchas como de costumbre.
Ejemplo
El estroncio tiene la misma configuración electrónica que el criptón, pero con dos electrones más en la subcapa s. Use la notación estándar abreviada para representar su configuración electrónica.
Una vez más, esto es muy sencillo: todo lo que tenemos que hacer es escribir [Kr] 5s 2
Representación de la configuración electrónica: forma de caja
La forma de caja es una forma un poco más larga de representar la configuración electrónica, pero a diferencia de la notación estándar, muestra la posición de los electrones dentro de los orbitales individuales.
Representas los diferentes orbitales en cada subcapa usando cuadros cuadrados y muestras los electrones usando flechas verticales. Es tradicional dibujar el primer electrón en cada orbital apuntando hacia arriba y el segundo apuntando hacia abajo.
Forma de caja ejemplo
Aquí está la configuración electrónica del carbono (1s 2 2s 2 2p 2 ) en forma de caja:

A continuación, veremos cómo elaboramos esta configuración electrónica.
Configuración electrónica de los elementos
Ahora pondremos a prueba nuestros nuevos conocimientos con algunos ejemplos. Primero, resolveremos las configuraciones electrónicas de los elementos.
Configuración electrónica de los elementos ejemplo
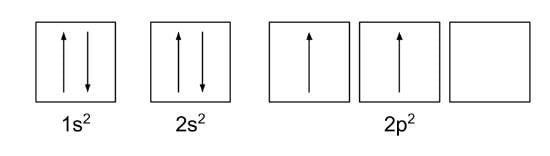
Utilice el principio de Aufbau y la regla de Hund para calcular la configuración electrónica del carbono en forma de caja.
Notarás que este es el ejemplo que dimos anteriormente, pero ahora te mostraremos cómo hacerlo.
El carbono tiene un número de protones de 6, lo que significa que también contiene seis electrones. De acuerdo con el principio de Aufbau, los electrones llenarán primero las subcapas de menor nivel de energía.
Por lo tanto, dos electrones primero llenarán el orbital único en 1s. Dos electrones más llenarán el orbital único en 2s, la subcapa con el siguiente nivel de energía más bajo. Esto deja dos electrones para ir en 2p. Sin embargo, de acuerdo con la regla de Hund, los electrones preferirán ir a orbitales separados dentro de una subcapa. La configuración electrónica general se muestra a continuación .
Otro ejemplo es el sodio.
Dé la configuración electrónica del sodio usando notación estándar.
El sodio tiene once electrones. Como el carbono, sus primeros dos electrones llenarán 1s y los siguientes dos llenarán 2s. Los próximos seis electrones llenarán 2p, dejando un electrón. Esto va en 3s, el siguiente nivel de energía más bajo, como se muestra:
1s 2 2s 2 2p 6 3s 1
El siguiente: oxígeno.
Dé la configuración electrónica del oxígeno en forma de caja.
El oxígeno tiene ocho electrones. Sus primeros dos electrones llenan 1s, mientras que sus dos segundos llenan 2s. Sus próximos cuatro van en 2p. Gracias a la regla de Hund, los primeros tres de estos cuatro se encuentran en orbitales separados. Sin embargo, la subcapa 2p solo tiene tres orbitales electrónicos, por lo que el cuarto y último electrón tiene que duplicarse y compartir uno que ya está ocupado:

Es posible que haya notado un patrón. La posición de un elemento en el tabla periódica se relaciona con la subcapa en la que se encuentra su electrón más externo. Un átomo neutro de Grupo 2 siempre tiene su electrón externo en una subcapa s, por ejemplo, mientras que un metal de transición tiene su electrón externo en una subcapa ad. Esto se muestra a continuación.
![Un diagrama de latabla periódica, que muestra cómo la posición de un elemento se relaciona con la subcapa en la que se encuentra su electrón externo. DePiep, CC BY-SA 3.0, commons.wikimedia.org[2]](https://ipparaguay.com.py/wp-content/uploads/2022/11/Un-diagrama-de-latabla-periodica-que-muestra-como-la-posicion-de-un-elemento-se-relaciona-con-la-subcapa-en-la-que-se-encuentra-su-electron-externo.-DePiep-CC-BY-SA-3.0-commons.wikimedia.org2_.jpg)
Configuración electrónica de iones
Sabemos cómo llenar subcapas y orbitales con electrones para formar átomos neutros, pero ¿cómo ganan o pierden electrones adicionales para formar iones?
- Al ganar electrones , la regla de Hund y el principio de Aufbau se siguen como de costumbre. Esto forma un anión negativo .
- Cuando se pierden electrones , los electrones se pierden primero desde el nivel de energía más alto , es decir, en orden inverso al llenado. Esto forma un catión positivo . Sin embargo, hay otra excepción furtiva a la regla: los electrones 4s se pierden antes que los electrones 3d .
Veamos un ejemplo.
Dé la configuración electrónica de los iones Ca 2+ .
Los átomos de calcio, Ca, tienen la configuración electrónica 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 . Al perder electrones, los pierden primero desde el nivel de energía más alto.
En este caso, eso es 4s. Los iones Ca 2+ han perdido dos electrones y también la configuración electrónica 1s 2 2s 2 2p 6 3s 2 3p 6 4s 0 . Esto también se puede escribir simplemente como 1s 2 2s 2 2p 6 3s 2 3p 6 .
Excepciones a la configuración electrónica
Probablemente ya habrá adivinado que, aunque la química es un tema lógico, siempre hay algunos casos que parecen ignorar todas las reglas estándar. Desafortunadamente, solo tiene que aprenderlos, aunque tomarse el tiempo para comprender por qué se comportan mal puede ayudarlo a recordarlos.
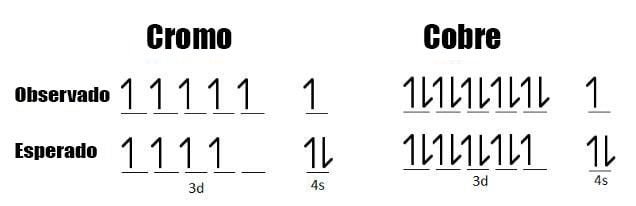
Toma cromo. El cromo, Cr, tiene veinticuatro electrones y la configuración 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5 . Espera un segundo: ¿por qué solo hay un electrón en la subcapa 4s? ¡Esperaríamos que la configuración de Chrome sea 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 4 ! Bueno, esto se debe a que las subcapas 4s y 3d son muy similares en el nivel de energía.
El electrón solitario en 4s no experimenta ninguna repulsión porque no está emparejado, y esta repulsión electrón-electrón reducida compensa el hecho de que hay un electrón adicional en el nivel de energía 3d ligeramente más alto. A los átomos les gusta estar en el estado de energía más bajo posible .
Asimismo, el cobre, Cu, tiene la configuración 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 , no 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 9 . Esto nuevamente es un arreglo de energía ligeramente reducido debido a la falta de repulsión electrón-electrón.
Evidencia de configuración electrónica
Para concluir este artículo, consideraremos brevemente algunas de las pruebas de la configuración electrónica:
- Los espectros de emisión atómica nos dicen que existen diferentes niveles de energía cuántica. Los espectros de emisión atómica se producen cuando los electrones excitados emiten luz y regresan a su estado fundamental, que es su nivel de energía más bajo. La longitud de onda y la frecuencia de la luz dependen del nivel de energía del electrón.
- Las energías de ionización sucesivas también nos dan evidencia de capas de electrones. Los grandes saltos entre las energías de ionización sucesivas de un elemento indican que el electrón se pierde en una capa de electrones diferente que está más cerca del núcleo.
- Las primeras energías de ionización nos dan evidencia de subcapas y orbitales. Por ejemplo, la disminución de la primera energía de ionización entre los grupos 2 y 3 muestra que existen las subcapas syp, mientras que la disminución de la primera energía de ionización entre los grupos 5 y 6 muestra que la subcapa p contiene tres orbitales.
Configuración electrónica: puntos clave
- La configuración electrónica también se conoce como configuración electrónica y describe la disposición de los electrones en un átomo .
- Los electrones llenan las capas de acuerdo con sus niveles de energía , según lo dictado por el principio de Aufbau y la regla de Hund . Los electrones primero llenan las subcapas con un nivel de energía más bajo , y dentro de cada subcapa prefieren ocupar su propio orbital .
- Cuando se forman iones, los electrones generalmente se pierden primero en la subcapa de mayor nivel de energía .
- Las excepciones a las reglas de llenado se derivan del hecho de que las subcapas 4s y 3d son similares en nivel de energía . Recuerde siempre que la subcapa 4s se llena antes que la subcapa 3d .
- Las energías de ionización primera y sucesivas nos dan evidencia de la configuración electrónica.
Preguntas frecuentes sobre la configuración electrónica
La configuración electrónica es la disposición de los electrones en capas, subcapas y orbitales dentro del átomo.
La configuración electrónica se resuelve llenando primero las capas del nivel de energía más bajo (principio de Aufbau) y luego llenando primero los orbitales vacíos dentro de cada subcapa (regla de Hund).
El sodio tiene la configuración electrónica 1s 2 2s 2 2p 6 3s 1 .
El carbono tiene la configuración electrónica 1s 2 2s 2 2p 2 .
El calcio tiene la configuración electrónica 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 .
1/1840
Arriba y abajo
Los electrones llenan primero el nivel de energía más bajo disponible.
Los electrones llenan orbitales vacíos del mismo nivel de energía antes de emparejarse con otro electrón en un orbital.
4s, 3d, 3p, 2s
Azufre
Pérdida de energía: lo que significa que un electrón bajará un nivel de energía, lo que significa que se producirá una emisión de energía.
Requerirá un electrón para ganar energía y subir un nivel de energía (capa).
Puede absorber una frecuencia discreta del espectro electromagnético o un cuanto de luz.
Verdadero
Principio de Aufbau, principio de exclusión de Pauli, regla de Hund
regla de hund
Verdadero
No
No, ya que primero tienen que llenar las capas de energía más bajas.
No, debido a la falta de presencia de la energía necesaria para que los electrones pasen a estados de mayor energía.
-1/2 debido al principio de exclusión de Pauli que establece que los electrones siempre deben tener estados de espín opuestos.
Sí, aquellos con números atómicos consecutivos pueden mostrar que la configuración electrónica se construye una encima de la otra con un electrón extra en cada caso.
Los átomos en estado excitado se representan con un asterisco al lado del símbolo del elemento.
Diagramas de cajas y flechas.
Sí, especialmente si está en estado fundamental.
▶️ Índice:





