Tabla Periódica: Imagina que estás haciendo un rompecabezas. A medida que el reloj avanza, usted organiza todas y cada una de las piezas, haciendo coincidir cada parte hasta que finalmente, con alivio y una sensación de logro, forma la imagen. Bastante complicado, ¿verdad?
Ahora, imagina hacer el mismo rompecabezas con la mitad de las piezas faltantes y sin una imagen terminada que te ayude. Esto es lo que debieron sentir los químicos cuando intentaban ordenar todos los elementos en lo que ahora conocemos como la tabla periódica .
Lo que encontrarás en este artículo
- Veremos la tabla periódica en química Física.
- Comenzaremos definiendo la misma, antes de ver cómo está estructurada.
- Luego exploraremos su historia.
- Al final de este artículo, debería poder explicar cómo está estructurada la tabla periódica, comparar filas, columnas y bloques en la misma y describir cómo ha cambiado la tabla periódica con el tiempo.
Tabla periódica de los elementos
Aquí está la definición de la tabla periódica:
Definición de Tabla Periódica
La misma es una muestra de elementos ordenados según su número atómico.
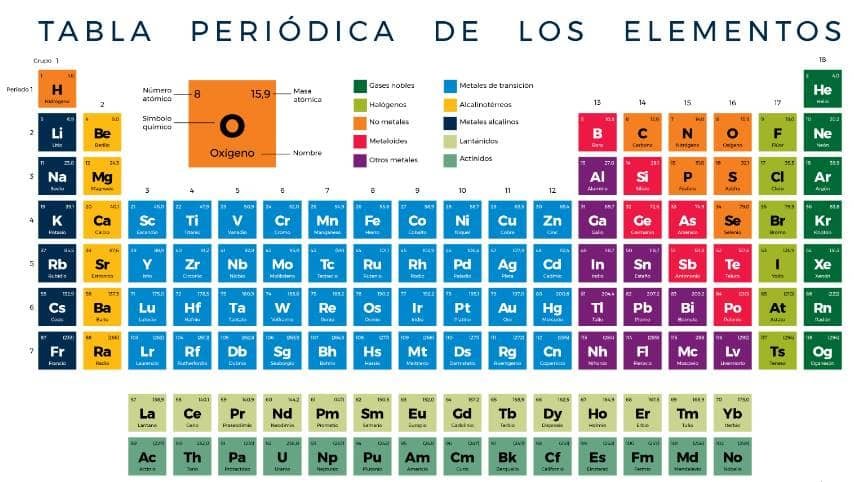
La tabla periódica es útil porque ordena los elementos en filas y columnas según sus propiedades. Esto significa que una vez que conoce la posición de un elemento en la misma, puede predecir cómo se comporta y reacciona . Comencemos mirando su estructura.
¿Cómo está estructurada la tabla periódica?
En primer lugar, la tabla periódica consta de elementos . Estos elementos se ensamblan en filas , columnas y bloques . No siempre ha sido así , pero veremos cómo ha cambiado más adelante, cuando discutamos la historia de la tabla periódica. A partir de ahora, profundizaremos en las formas en que se estructura la tabla periódica.
Elementos
Como definimos anteriormente, la tabla periódica es un arreglo de elementos . Recuerde que un elemento es una sustancia química pura que consta de átomos que tienen todos la misma cantidad de protones en sus núcleos. Su número exacto de protones determina su número de electrones; esto es lo que hace que un elemento, bueno, ¡ un elemento !
Los elementos de la tabla periódica se muestran usando su símbolo químico. Esta es una abreviatura de una o dos letras, única para cada elemento. La primera letra siempre está en mayúscula y la segunda letra en minúscula. Por ejemplo, el cobre se conoce como Cu, el calcio como Ca y el carbono como C. Los elementos también se muestran con su número atómico y Masa atómica relativa.
Definición de Número Atómico
El número atómico de un elemento es el número de protones que se encuentran en su núcleo, mientras que su Masa atómica relativa es la masa promedio de un átomo en el elemento. Esta es la masa de los protones y neutrones en el núcleo del átomo. La masa atómica relativa se mide en una escala particular, donde un átomo de carbono-12 tiene una masa de exactamente 12.

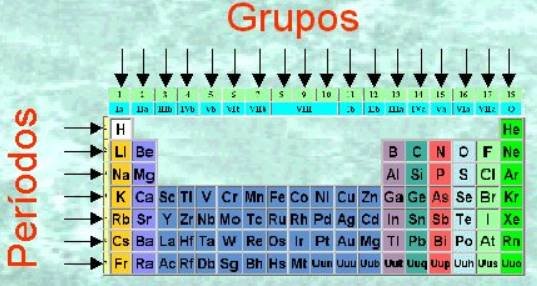
Períodos
Una de las formas en que los elementos se ensamblan en la tabla periódica es en filas . Una fila en la tabla periódica se conoce como período ; de ahí viene la palabra periódico . Las filas de la tabla periódica muestran la periodicidad.
Definición de periodicidad
La periodicidad se refiere a las tendencias que ve a medida que avanza en un período (fila) en la tabla periódica. Estas tendencias se repiten con cada nuevo período.
Los elementos de un período se ordenan por número atómico creciente . Recuerda que el número atómico es el número de protones en un elemento. El número atómico aumenta en 1 cada vez que se mueve de izquierda a derecha en un período de la tabla. Cuando llega al final de un período, se mueve hacia abajo y hacia la izquierda hasta el comienzo de uno nuevo, y continúa contando números atómicos desde allí. En total hay 7 periodos en la tabla periódica .


Los elementos en el mismo período tienen el mismo número de capas de electrones. Por ejemplo, los elementos en el período 1 tienen solo una capa de electrones, mientras que los elementos en el período 5 tienen cinco capas de electrones.
Grupos de la tabla periódica
Los elementos de la misma también se ensamblan en columnas . Estas columnas se denominan grupos . En total, hay 18 grupos en la tabla periódica, con la numeración oficial de la IUPAC del 1 al 18. Sin embargo, para el propósito de su curso, seguiremos el sistema de numeración tradicional que es 1-0 o 1-8 . Esto a menudo se muestra en números romanos. Los grupos son:
- Metales alcalinos (grupo I)
- Metales alcalinotérreos (grupo II)
- Grupo boro (grupo III)
- Grupo de carbono (grupo IV)
- Los pnictógenos (grupo V)
- Los calcógenos (grupo VI)
- los halógenos(grupo VII)
- Gases nobles (grupo VIII)
Los elementos se agrupan según el número de electrones que tienen en su capa externa . Los electrones de la capa externa también se conocen como electrones de valencia. Los electrones de valencia determinan las propiedades químicas y la reactividad de un elemento. Esto significa que todos los elementos en el mismo grupo reaccionan de manera similar. Sin embargo, tenga en cuenta que cada elemento en un grupo tiene una capa de electrones más que el elemento que está arriba.
Definición de electrones de valencia
Los electrones de valencia son los electrones que se encuentran en la capa externa de un átomo.
El antiguo sistema de numeración es útil porque nos da una indicación de cuántos electrones de valencia tiene un elemento en un grupo particular. Por ejemplo, todos los elementos del grupo I, los metales alcalinos, tienen un electrón de valencia. En cambio, todos los elementos del grupo VII, el halógenos, tiene siete electrones de valencia. Los gases nobles, grupo VIII, tienen todos ocho electrones de valencia, lo que les da una temperatura exterior completa capas de electrones.
El grupo I también incluye hidrógeno, aunque no es un metal alcalino y reacciona de manera bastante diferente a los otros miembros del grupo. Con un número atómico de 1, el hidrógeno es el elemento más ligero que existe. Tiene solo un protón y un electrón. Por lo tanto, podría esperar encontrar el siguiente elemento más ligero, el helio, al lado del grupo II, ya que solo tiene dos protones y dos electrones. Sin embargo, el helio se encuentra en cambio en el grupo VIII. Esto se debe a que la capa de electrones de valencia del helio solo tiene espacio para dos electrones, lo que significa que el helio en realidad tiene una capa exterior llena de electrones. Esto hace que se comporte como los demás elementos del grupo VIII.
El número de grupos en la tabla periódica, que es 18, fue recomendado por la Unión Internacional de Química Pura y Aplicada ( IUPAC) en 1988. Reemplazó el antiguo sistema de numeración, 1–0 o 1–8 (que excluye el d – y elementos f-block, que veremos más adelante). El sistema anterior todavía es de uso común, especialmente en las juntas de exámenes de inglés (AQA) y escocés (SQA), y es la versión que necesita conocer.
Bloques
Es posible que hayas notado que al usar el antiguo sistema para numerar grupos se pierden dos grandes partes de la tabla periódica. ¿Qué pasa con los elementos entre los grupos II y III, que se encuentran en los grupos 3 a 12 de la IUPAC? ¿Qué hay de esas dos filas de elementos debajo de la misma? ¿Dónde encajan? Bueno, otra forma de ver la tabla periódica es dividiéndola en bloques .
Definición de Bloques
Los bloques en la tabla periódica son grupos de elementos que tienen su electrón de valencia de mayor energía en la misma subcapa.
Hay cuatro bloques en la tabla periódica:
- Todos los elementos del bloque s tienen su electrón de valencia de mayor energía en una subcapa s. El bloque s incluye los grupos I y II.
- Todos los elementos del bloque p tienen su electrón de valencia de mayor energía en una subcapa p. El bloque p incluye los grupos III a VIII, o en términos de IUPAC, 13 a 18, y está compuesto principalmente por no metales.
- Todos los elementos del bloque d tienen su electrón de valencia de mayor energía en una subcapa d. El bloque d incluye los grupos 3 a 12 y también presenta el metales de transición.
- Todos los elementos del bloque f tienen su electrón de valencia de mayor energía en una subcapa f. El bloque f incluye los lantánidos y los actínidos . Estas son las dos filas que se muestran debajo del cuerpo principal de la tabla periódica. Hemos mostrado dónde encajan en relación con los otros elementos en la tabla periódica a continuación.
Sí, sabemos que dijimos que el helio estaba en el grupo VIII, pero en lugar de estar en el bloque p como todos los demás elementos del grupo VIII, se encuentra en el bloque s. ¿Recuerdas que su capa exterior solo tiene espacio para dos electrones? Esto se debe a que la capa contiene solo una subcapa s, mientras que todos los demás miembros del grupo VIII también tienen una subcapa p. Esto significa que el electrón de valencia de mayor energía del helio se encuentra en una subcapa s, lo que lo convierte en un elemento del bloque s.
Tabla Periódica Metales, no metales y metaloides
La forma final de estructurar la tabla que veremos hoy consiste en dividir la tabla con una línea en zigzag. Comienza a la izquierda del boro y serpentea hacia abajo y hacia la derecha, deslizándose entre el silicio y el germanio, luego entre el arsénico y el antimonio y el telurio y el polonio. Finalmente, divide astatine de tennessine, antes de terminar a la izquierda de oganesson.
Esta línea tiene varios nombres: la línea metal-no metal, la línea anfótera, la línea metaloide y la escalera. Divide la tabla en metales, no metales y metaloides.
- Los elementos a la izquierda de la línea se clasifican como metales.
- Los elementos a la derecha de la línea (así como el hidrógeno) se clasifican como no metales.
- Algunos de los elementos que tocan la línea se clasifican como metaloides.

Rieles
Los metales aparecen en el lado izquierdo de la tabla periódica. Tienen algunas propiedades características.
- Los metales suelen perder electrones para formar cationes positivos.
- Tienen altos puntos de fusión y ebullición.
- También tienen bajo electronegatividad valores.
- Tienen un aspecto brillante y lustroso cuando están recién cortadas.
- Son maleables y dúctiles.
- Son buenos conductores del calor y la electricidad.
También te puede Interesar: Electronegatividad ✓ Definición ✓ Ejemplos ✓ Fórmula ✓ Factores afectan
No metales
Los no metales se encuentran en el lado derecho de la tabla periódica (a excepción del hidrógeno, que también es un no metal). Como sugiere su nombre, son los opuestos de los metales. De hecho, puede pensar que simplemente carecen de características metálicas.
- Los no metales suelen ganar electrones para formar aniones negativos.
- Tienen altos valores de electronegatividad .
- Exhiben una gama de puntos de fusión y ebullición. Algunos, como el silicio, tienen puntos de fusión extremadamente altos, mientras que otros, como el oxígeno, tienen puntos de fusión bajos.
- Los no metales sólidos son frágiles.
- Son malos conductores del calor y la electricidad.
Metaloides
Los metaloides se encuentran en el centro de la tabla periódica. Se extienden a ambos lados de la línea divisoria que divide los metales de los no metales, y sus propiedades están a medio camino entre los dos.
- Por lo general, los metaloides son brillantes y lustrosos cuando se cortan, pero son frágiles por naturaleza.
- Tienen valores de electronegatividad medios.
- Son conductores medios de la electricidad.
Importante
No existe una definición científica fija de metal, no metal y metaloide. Debido a esto, diferentes fuentes pueden clasificar ciertos elementos de manera diferente y, de hecho, algunos científicos incluso trazan la línea divisoria en un lugar diferente. Por ejemplo, el carbono y el selenio a veces se reconocen como metaloides.
Ahora sabemos cómo es la tabla periódica y cómo está estructurada. Pero, ¿cómo llegó a ser de esta manera?
Historia de la tabla periodica
Al comienzo del artículo, comparamos la creación de la primera versión de la tabla periódica con intentar armar un rompecabezas al que le faltan la mitad de las piezas y no hay una imagen que lo guíe. Para los químicos de los años previos al siglo XIX, este fue el desafío al que se enfrentaron. Centrémonos en tres científicos y las contribuciones que hicieron a la tabla periódica moderna.
Johann Wolfgang Dobereiner
En 1817, el físico alemán Johann Wolfgang Döbereiner fue el primero en intentar clasificar los elementos. Notó que podías poner ciertos elementos en grupos de tres, llamados tríadas , y que los elementos dentro de una tríada compartían propiedades similares. De hecho, las propiedades del segundo elemento de la tríada estaban a mitad de camino entre las del primero y las del tercero. Por ejemplo, agrupó el litio, el sodio y el potasio, todos los metales que ahora sabemos que están en el Grupo I.
Juan Newland
En 1864, el químico británico John Newlands también notó las similitudes en las propiedades entre ciertos elementos. Vio que si ordenabas todos los elementos en una tabla por masa atómica, sus propiedades se repetían a intervalos regulares. Estas propiedades se repetían cada ocho elementos, lo que llevó al nombre de ‘la ley de las octavas’.
Sin embargo, en ese momento, solo se habían descubierto unos 60 elementos. Newlands asumió erróneamente que esos eran los únicos elementos que existían. No dejó huecos para ningún elemento no descubierto, por lo que su tabla realmente no tenía sentido después del calcio. A veces también ponía dos elementos en la misma caja. En general, sus ideas fueron ridiculizadas por sus compañeros.
Dmitri Mendeleiev
Finalmente, en 1869, el químico ruso Dmitri Mendeleev llegó a la versión de la tabla periódica que conocemos hoy. Tomó la idea de Newlands sobre la ley de las octavas, pero dejó espacios para los elementos no descubiertos, prediciendo sus propiedades a partir del comportamiento de los elementos que los rodeaban. Aunque en su mayoría dispuso los elementos en orden de masa atómica, cambió algunos de ellos para que encajaran mejor con su ley de las octavas.
Por ejemplo, el argón era mucho más pesado que el potasio, pero anteponer el potasio al argón significaría que el potasio metálico altamente reactivo estaría en un grupo con gases no metálicos no reactivos, mientras que el argón no reactivo estaría en un grupo con metales reactivos. Su tabla fue aceptada gradualmente cuando se descubrieron nuevos elementos que coincidían con sus propiedades predichas. El problema de la masa atómica se resolvió cuando se descubrieron las partículas subatómicas en el siglo XX y los científicos se dieron cuenta de que los elementos realmente deberían ordenarse por número atómico , y no por masa.
Tabla periódica: conclusiones clave
- La tabla periódica es una muestra de elementos ordenados según sus números atómicos.
- La tabla periódica está estructurada en filas, columnas y bloques.
- Una fila en la tabla periódica se conoce como período. Los períodos muestran periodicidad, lo que significa que muestran tendencias en sus propiedades que se repiten en cada fila. El número atómico aumenta a medida que avanzas en un período de la tabla periódica.
- Una columna en la tabla periódica se conoce como un grupo. Los elementos del mismo grupo tienen el mismo número de electrones de valencia y reaccionan de manera similar.
- La tabla periódica se divide en bloques. Los bloques son grupos de elementos que tienen su electrón de valencia de mayor energía en la misma subcapa.
- También puede clasificar los elementos en metales, no metales y metaloides. Los metales se encuentran a la izquierda de la tabla periódica, mientras que los no metales se encuentran a la derecha. Los metaloides se encuentran entre los dos.
- Las versiones anteriores de la tabla periódica ordenaban los elementos por masa atómica, no por número atómico. La tabla periódica moderna tal como la conocemos hoy en día fue creada por Dmitri Mendeleev en 1869.
Preguntas frecuentes sobre la tabla periódica
¿Cuántos elementos hay en la tabla periódica?
118
¿Qué es la tabla periódica?
Una disposición tabular de elementos químicos que se ordena por número atómico creciente y agrupa elementos según propiedades recurrentes.
¿Cómo se ordenan los elementos en la tabla periódica?
Los elementos de la tabla periódica están ordenados por orden creciente de número atómico.
¿Quién inventó la tabla periódica?
El químico Dmitri Mendeleev inventó la tabla periódica.
¿Cómo se llaman las filas de la tabla periódica?
Las filas se llaman períodos.
¿Cuál es la clasificación correcta del elemento Zr, circonio?
bloque d
¿Cuál es la ecuación correcta para la segunda energía de ionización del rubidio?
Rb + (g) → Rb2 + (g) + e–
¿Cuál es la unidad de radio atómico?
pm
¿En qué orden están ordenados los elementos en la tabla periódica?
Aumento del número atómico
¿Por qué aumenta la electronegatividad a lo largo de un período?
Electrón en el mismo blindaje similar a la capa
¿Cuál de estos elementos tiene el radio atómico más grande?
k
Número atómico __ a medida que avanza por un período en la tabla periódica.
Aumenta
¿Verdadero o falso? Los elementos del mismo grupo tienen el mismo número de capas de electrones.
Falso
¿Cuántos electrones de valencia tienen los elementos del grupo I?
1
¿Cuántos electrones de valencia tienen los elementos del grupo VII?
7
¿Qué grupo de la tabla periódica tiene una capa exterior llena de electrones?
Grupo VIII, también conocido como grupo 0
¿Cuántas capas de electrones tienen los elementos en el período 3?
3
¿Cuántos electrones de la capa externa tienen los elementos del período 3?
Eso depende
¿Cómo se conocen las columnas de la tabla periódica?
Grupos
¿Cómo se conocen las filas de la tabla periódica?
Períodos
¿Cuántos grupos hay en la tabla periódica, según la nomenclatura de la IUPAC?
18
Los elementos en el mismo bloque tienen todos _.
El mismo número de electrones de la capa exterior
¿Cuáles de las siguientes son propiedades típicas de los metales?
Altos puntos de fusión y ebullición.
¿Cuáles de las siguientes son propiedades típicas de los no metales?
alta electronegatividad
Fuente: wikipedia
▶️ Índice:





