Partículas fundamentales: Los átomos están en todas partes. De hecho, (casi) todo en el universo conocido está formado por átomos o espacio vacío.
¿Qué son las Partículas fundamentales?
Y son diminutos: un centavo de cobre estadounidense de 2,5 g contiene aproximadamente átomos. Pero, ¿Qué es exactamente un átomo?
Lo que encontrarás en este artículo
- Ubicación de las partículas fundamentales
- ¿Cómo influyen las partículas fundamentales de un átomo en sus propiedades?
- Partículas fundamentales: conclusiones clave
- Preguntas frecuentes sobre partículas fundamentales
- Cuestionario final de partículas fundamentales
Definición de Átomo
Un átomo es la unidad más pequeña de un elemento.
El filósofo griego antiguo Demócrito fue uno de los primeros en creer en la existencia de los átomos hace más de 2000 años. Creía que los átomos eran indestructibles, no tenían estructura interna y que los átomos de la misma sustancia eran todos idénticos . Incluso la palabra átomo en sí proviene del griego atomus , que significa indivisible. Sin embargo, ahora sabemos que solo tenía parte de razón.
Los átomos contienen partículas más pequeñas, llamadas protones, neutrones y electrones. Estas partículas se conocen como partículas subatómicas o fundamentales , y la teoría de las partículas subatómicas y cómo interactúan se conoce como Modelo Estándar.
Definición de Partículas
Las partículas fundamentales son partículas que se encuentran dentro de un átomo que no están hechas de ninguna otra partícula. Esto significa que no se pueden dividir más.
Como se mencionó anteriormente, hay tres tipos fundamentales de partículas subatómicas:
- protones.
- neutrones.
- electrones
Importante
Para este nivel de conocimiento, consideramos a los protones, neutrones y electrones como partículas fundamentales, es decir, que no están formados por ninguna otra partícula.
Pero este no es realmente el caso. Los científicos cuánticos consideran que los protones y los neutrones están formados por partículas llamadas quarks, una verdadera partícula fundamental.
Los electrones son un poco diferentes. Cuando se encuentran orbitando en un átomo o molécula, se pueden dividir en tres partículas diferentes llamadas holones, espinones y orbitones, pero si se encuentran fuera de un átomo o molécula, no se pueden dividir. Esto significa que un electrón aislado ES una partícula fundamental, pero un electrón que forma parte de un átomo o molécula NO LO ES.
Protones
Los protones son partículas cargadas positivamente . ¡Son bastante pequeños! De hecho, un protón es solo aprox . kg, pero tendemos a medir su masa usando la escala de carbono-12. En esta escala, todo se compara con 1/12 de la masa de un átomo de carbono-12. Aquí los protones tienen una masa de aproximadamente 1.
Encontrarás protones empaquetados densamente en el núcleo en el centro del átomo. Son bastante importantes, porque una vez que sabes el número de protones en un átomo, sabes en qué parte de la tabla periódica lo encontrará y de qué elemento forma parte.
Neutrones
Los neutrones son partículas neutras con una masa relativa de aproximadamente 1. También se encuentran junto a los protones en el núcleo . El número de neutrones puede variar entre átomos del mismo elemento sin cambiar sus propiedades químicas.
Electrones
Los electrones son partículas negativas . Son incluso más pequeños que los protones: los electrones tienen una masa real de Kg, o una masa relativa de 1/1840 en la escala de carbono-12. No se encuentran junto a protones y neutrones. En cambio, los electrones pasan su tiempo en niveles de energía , también conocidos como capas , que orbitan alrededor del núcleo. Los niveles de energía aumentan de energía a medida que se alejan del núcleo, y los electrones siempre intentan estar en el nivel de energía más bajo posible . Veremos esto más adelante en el artículo.
El número de electrones en un átomo determina sus propiedades químicas y cómo reacciona.
Los átomos no tienen carga total, y esto significa que contienen la misma cantidad de electrones que de protones. Si un átomo gana o pierde un electrón para convertirse en una partícula cargada, forma un ion .
Definición de un Ion
Un ion es un átomo que ha ganado o perdido un electrón para formar una partícula cargada.
La siguiente tabla muestra las masas y cargas relativas de las tres partículas fundamentales:

Ubicación de las partículas fundamentales
A principios del siglo XX, el físico JJ Thompson propuso que un átomo contenía pequeñas partículas cargadas negativamente dispersas al azar en un mar de carga positiva. Sin embargo, ahora sabemos que no es del todo así. En cambio, un átomo contiene anillos de electrones, conocidos como capas , que orbitan alrededor de una masa densa llamada núcleo .
El núcleo
Los protones y los neutrones se encuentran densamente agrupados en el núcleo , el centro del átomo. Recordarás que los protones tienen carga positiva mientras que los neutrones son neutros. Esto hace que el núcleo también esté cargado positivamente. Sin embargo, a las partículas con la misma carga realmente no les gusta estar juntas, tienden a repelerse entre sí. Una fuerza extremadamente poderosa llamada fuerza nuclear fuerte mantiene a los protones y neutrones juntos en una masa increíblemente pequeña y densa.

Capas de electrones
A diferencia de los protones y los neutrones, los electrones se encuentran en capas que orbitan alrededor del núcleo. Estas capas también se conocen como niveles de energía y están organizadas en subcapas y orbitales . Veremos las capas con más detalle en el artículo “Capas, subcapas y orbitales de electrones”. Sin embargo, debes saber algunos conceptos básicos:
- Las capas de electrones se dividen en subcapas, cada una de las cuales puede contener diferentes números de orbitales y electrones.
- Las capas aumentan de energía a medida que se alejan del núcleo.
- Los electrones son bastante quisquillosos y les gusta estar en el estado de energía más bajo posible . Cuando se trata de caparazones, siempre se llenarán de adentro hacia afuera si se les da la opción, es decir, desde el nivel de energía más bajo hasta el nivel de energía más alto.
- De manera similar, a los átomos les gusta mucho tener capas externas llenas de electrones . Esto significa que a menudo ganarán o perderán fácilmente electrones para completar su capa exterior.
- Las capas en realidad no nos dicen dónde está un electrón; de hecho, es imposible saber la ubicación precisa de un electrón y hacia dónde se dirige. En cambio, las capas nos dan una aproximación aproximada de dónde estará el electrón la mayor parte del tiempo.
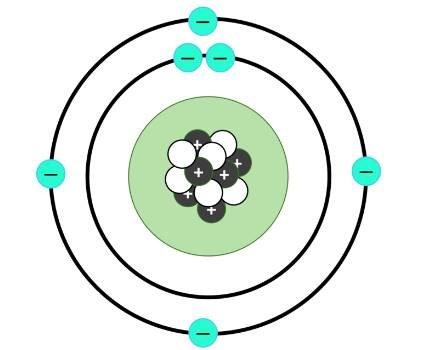
A diferencia de los protones y los neutrones, los electrones son partículas negativas. Son atraídos al núcleo positivo por una fuerza llamada atracción electrostática . Sin embargo, esto es mucho más débil que la fuerza nuclear fuerte que mantiene unidos a los protones y los neutrones.
Debes recordar que aunque pueda parecer caótico en un átomo, con todos los electrones corriendo alrededor del núcleo extremadamente denso y altamente cargado, la gran mayoría del átomo es en realidad espacio vacío. Tome un átomo de hidrógeno, por ejemplo. Contiene un solo protón en su núcleo y está orbitado por un electrón. Si todo el átomo de hidrógeno fuera del tamaño de la Tierra, ¡el protón en sí solo tendría 200 m de diámetro! O para decirlo de otra manera, si hicieras estallar un átomo del tamaño de un estadio de fútbol, su núcleo sería apenas visible: sería del tamaño de una canica.
¿Cómo influyen las partículas fundamentales de un átomo en sus propiedades?
¿Qué hace que el hidrógeno reaccione de manera tan diferente al helio? ¿Qué causa que el sodio burbujee violentamente si se coloca en agua mientras que el carbón humedecido no parece hacer nada? Las tres partículas fundamentales exploradas anteriormente determinan las características de un átomo, las reacciones que sufrirá y de qué elemento forma parte:
- El número de protones determina en qué elemento está el átomo y su posición en la tabla periódica. Por ejemplo, cada átomo de carbono tiene exactamente seis protones. Si perdiera un protón, se convertiría en boro.
- El número combinado de protones y neutrones tiene poca influencia en las propiedades químicas del átomo, pero aumenta su masa y por lo tanto cambia su propiedades físicas.
- El número de electrones presentes cambia drásticamente las propiedades químicas de un átomo al cambiar su configuración electrónica. Recuerde que los átomos prefieren tener capas externas llenas de electrones, y su reactividad depende de qué tan cerca estén sus capas externas de estar llenas. El argón es un gas noble con una capa exterior completa, por lo que es relativamente poco reactivo, mientras que los metales como el sodio, el litio y el potasio deben almacenarse en aceite para evitar que reaccionen con el aire.
Partículas fundamentales: conclusiones clave
- Los átomos están formados por tres partículas fundamentales llamadas protones, neutrones y electrones.
- Los protones y los neutrones se encuentran en el núcleo en el centro del átomo, mientras que los electrones se encuentran en las capas que orbitan alrededor del núcleo.
- Los átomos son neutros y contienen el mismo número de protones que de electrones. Un átomo que ha ganado o perdido un electrón se llama ion.
- la configuración electrónica de un átomo determina sus propiedades químicas mientras que su número de protones determina su posición en la tabla periódica.
Preguntas frecuentes sobre partículas fundamentales
¿Qué son las partículas fundamentales?
Las partículas fundamentales son partículas que se encuentran dentro de un átomo que no están formadas por ninguna otra partícula.
¿Cuáles son las tres partículas fundamentales?
Las tres partículas fundamentales son protones, neutrones y electrones.
¿De qué están hechas las partículas fundamentales?
Por definición, las partículas fundamentales no están formadas por partículas más pequeñas.
¿Son los electrones partículas fundamentales?
Sí, los electrones son partículas fundamentales.
Cuestionario final de partículas fundamentales
La unidad más pequeña de un elemento más pequeña de un elemento.
Protón, neutrón y electrón.
1
Los neutrones son neutros y tienen una masa relativa de 1.
Los protones y los electrones tienen cargas opuestas.
1/1840
En el núcleo.
En conchas que orbitan alrededor del núcleo.
En el núcleo.
Tanto las fuerzas electrostáticas como las fuerzas nucleares fuertes se encuentran en un átomo. También Las fuerzas electrostáticas ocurren entre los electrones y el núcleo. La fuerza nuclear fuerte actúa entre protones y neutrones, dentro del núcleo. La fuerza nuclear fuerte es mucho más fuerte que las fuerzas electrostáticas.
Ambos se encuentran en el núcleo.
Los 2 se llenarán primero
2s
Oxígeno
El producto total tiene un protón, por lo que es un isótopo de hidrógeno.
Se convierte en berilio, un nuevo elemento.
Cambia las propiedades químicas ya que tiene una configuración electrónica diferente.
Tiene propiedades físicas ligeramente diferentes ya que ha aumentado en masa.
El campo eléctrico es una región alrededor de una partícula cargada en la que otras partículas cargadas experimentarán una fuerza.
F = q• mi
La carga
Las líneas de campo eléctrico en A son más densas que en B
Arriba
F = 9*10^9 Newtons hacia q1.
Creando una diferencia de potencial eléctrico entre las dos superficies.
18*10^9 voltios
Hacia la Carga
SeleccionLas líneas de campo eléctrico nos informan sobre el tipo de carga.a la(s) declaración(es) verdadera(s)
▶️ Índice: