Fuerzas intermoleculares: El carbono y el oxígeno son elementos similares. Tienen masas atómicas comparables y ambos forman moléculas unidas covalentemente.
¿Qué es Fuerzas intermoleculares?
En el mundo natural encontramos carbono en forma de diamante o grafito, y oxígeno en forma de moléculas de dioxígeno ( consulte Estructuras de carbono para obtener más información).
Sin embargo, el diamante y el oxígeno tienen puntos de fusión y ebullición muy diferentes. Mientras que el punto de fusión del oxígeno es de -218,8 °C, el diamante no se derrite en absoluto en condiciones atmosféricas normales.
En cambio, solo se sublima a la temperatura abrasadora de 3700°C. ¿Qué causa estas diferencias en propiedades físicas? Todo tiene que ver con las fuerzas intermoleculares e intramoleculares .
Definición de Fuerzas intermoleculares
Las fuerzas intermoleculares son fuerzas entre moléculas. En contraste, las fuerzas intramoleculares son fuerzas dentro de una molécula.
Fuerzas intramoleculares vs fuerzas intermoleculares
Veamos el enlace en el carbono y el oxígeno. El carbono es una estructura covalente gigante . Esto significa que contiene una gran cantidad de átomos que se mantienen unidos en una estructura reticular repetitiva por muchos enlaces covalentes.
Los enlaces covalentes son un tipo de fuerza intramolecular . En contraste, el oxígeno es una molécula covalente simple . Dos átomos de oxígeno se unen usando uno enlace covalente, pero no hay enlaces covalentes entre las moléculas.
En cambio, solo hay fuerzas intermoleculares débiles . Para derretir el diamante, necesitamos romper estos fuertes enlaces covalentes, pero para derretir el oxígeno simplemente necesitamos vencer las fuerzas intermoleculares.
Como está a punto de descubrir, romper las fuerzas intermoleculares es mucho más fácil que romper las fuerzas intramoleculares. Exploremos ahora las fuerzas intramoleculares e intermoleculares.
Fuerzas intramoleculares
Como definimos anteriormente, las fuerzas intramoleculares son fuerzas dentro de una molécula.
Incluyen enlaces iónicos , metálicos y covalentes . Debes estar familiarizado con ellos. (Si no, echa un vistazo a Covalente y Dativo Vinculación, Enlace iónico, y Unión metálica.) Estos lazos son extremadamente fuertes y romperlos requiere mucha energía.
Fuerzas intermoleculares
Una interacción es una acción entre dos o más personas. Algo que es internacional ocurre entre múltiples naciones. Asimismo, las fuerzas intermoleculares s son fuerzas entre moléculas.
Estos son más débiles que las fuerzas intramoleculares y no requieren tanta energía para romperse. Incluyen fuerzas de van der Waals (también conocidas como fuerzas de dipolo inducidas, fuerzas de London o fuerzas de dispersión ), fuerzas permanentes dipolo-dipolo y enlaces de hidrógeno . Los exploraremos en solo un segundo, pero primero debemos revisar la polaridad de los enlaces.
Polaridad de enlace
Como mencionamos anteriormente, hay tres tipos principales de fuerzas intermoleculares:
- Las fuerzas de van der Waals.
- Fuerzas permanentes dipolo-dipolo.
- Enlaces de hidrógeno.
¿Cómo sabemos cuál experimentará una molécula? Todo depende de la polaridad del enlace . El par de electrones enlazantes no siempre está espaciado por igual entre dos átomos unidos con un enlace covalente (recuerda Polaridad?). En cambio, un átomo podría atraer al par con más fuerza que el otro. Esto se debe a las diferencias en las electronegatividades .
Definición de Electronegatividad
Electronegatividad es la capacidad de un átomo para atraer un par de electrones enlazantes.
Un átomo más electronegativo atraerá el par de electrones en el enlace hacia sí mismo, quedando parcialmente cargado negativamente , dejando al segundo átomo parcialmente cargado positivamente . Decimos que este ha formado un enlace polar y la molécula contiene un momento bipolar.
Definición de dipolo
Un dipolo es un par de cargas iguales y opuestas separadas por una pequeña distancia.
Podemos representar esta polaridad usando el símbolo delta, δ, o dibujando una nube de densidad electrónica alrededor del enlace.
Por ejemplo, el enlace H-Cl muestra polaridad, ya que el cloro es mucho más electronegativo que el hidrógeno.

Sin embargo, una molécula con enlaces polares puede no ser polar en general. Si todos los momentos dipolares actúan en direcciones opuestas y se anulan entre sí, la molécula no tendrá dipolo . Si observamos el dióxido de carbono, podemos ver que tiene dos enlaces C=O polares. Sin embargo, debido a que
es una molécula lineal, los dipolos actúan en direcciones opuestas y se cancelan.
es por lo tanto una molécula no polar . No tiene general momento bipolar.
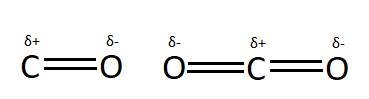
Tipos de fuerzas intermoleculares
Una molécula experimentará diferentes tipos de fuerzas intermoleculares dependiendo de su polaridad. Vamos a explorarlos cada uno a su vez.
Las fuerzas de van der Waals
Las fuerzas de Van der Waals son el tipo más débil de fuerza intermolecular. Tienen muchos nombres diferentes, por ejemplo, fuerzas de Londres , fuerzas dipolares inducidas o fuerzas de dispersión . Se encuentran en todas las moléculas , incluidas las no polares.
Aunque tendemos a pensar que los electrones están distribuidos uniformemente a lo largo de una molécula simétrica, en cambio, están en constante movimiento . Este movimiento es aleatorio y hace que los electrones se distribuyan de manera desigual dentro de la molécula.
Imagina agitar un recipiente lleno de pelotas de ping pong. En cualquier momento, puede haber una mayor cantidad de pelotas de ping pong en un lado del contenedor que en el otro. Si estas pelotas de ping pong tienen carga negativa, significa que el lado con más pelotas de ping pong también tendrá una ligera carga negativa, mientras que el lado con menos pelotas tendrá una ligera carga positiva.
Se ha creado un pequeño dipolo . Sin embargo, las pelotas de ping pong se mueven constantemente a medida que sacudes el recipiente, por lo que el dipolo también se sigue moviendo. Esto se conoce comodipolo temporal .
Si otra molécula se acerca a este dipolo temporal, también se inducirá un dipolo en ella.
Por ejemplo, si la segunda molécula se acerca al lado parcialmente positivo de la primera molécula, los electrones de la segunda molécula serán ligeramente atraídos por el dipolo de la primera molécula y todos se moverán hacia ese lado.
Esto crea un dipolo en la segunda molécula conocido como dipolo inducido . Cuando el dipolo de la primera molécula cambia de dirección, también lo hace el de la segunda molécula. Esto le sucederá a todas las moléculas en un sistema. Esta atracción entre ellos se conoce como fuerzas de van der Waals.
Definición de fuerzas de Van der Waals
Las fuerzas de Van der Waals son un tipo de fuerza intermolecular que se encuentra entre todas las moléculas, debido a dipolos temporales causados por el movimiento aleatorio de electrones.
Las fuerzas de Van der Waals aumentan en fuerza a medida que aumenta el tamaño de la molécula . Esto se debe a que las moléculas más grandes tienen más electrones. Esto crea un dipolo temporal más fuerte.

Fuerzas permanentes dipolo-dipolo
Como mencionamos anteriormente, las fuerzas de dispersión actúan entre todas las moléculas , incluso las que consideraríamos no polares. Sin embargo, las moléculas polares experimentan un tipo adicional de fuerza intermolecular. Las moléculas con momentos dipolares que no se anulan entre sí tienen algo que llamamos un dipolo permanente . Una parte de la molécula está parcialmente cargada negativamente, mientras que otra parte está parcialmente cargada positivamente . Los dipolos con carga opuesta en moléculas vecinas se atraen y los dipolos con carga similar se repelen . Estas fuerzas son más fuertes que las fuerzas de van der Waals ya que los dipolos involucrados son más grandes. Las llamamos fuerzas dipolo-dipolo permanentes.
Definición de fuerzas dipolo-dipolo
Las fuerzas dipolo-dipolo permanentes son un tipo de fuerza intermolecular que se encuentra entre dos moléculas con dipolos permanentes.
Para ilustrar el tercer tipo de fuerza intermolecular, echemos un vistazo a algunos haluros de hidrógeno. El bromuro de hidrógeno hierve a -67 °C. Sin embargo, el fluoruro de hidrógeno
no hierve hasta que la temperatura alcanza los 20 °C. Para hervir una sustancia covalente simple, debe vencer las fuerzas intermoleculares entre las moléculas. Sabemos que las fuerzas de van der Waals aumentan en fuerza a medida que aumenta el tamaño de la molécula. Como el flúor es un átomo más pequeño que el cloro, esperaríamos que el
tuviera un punto de ebullición más bajo. Esto claramente no es el caso.
¿Qué causa esta anomalía?
Mirando la tabla de abajo, podemos ver que el flúor tiene un alto electronegatividad valor en la escala de Pauling. Es mucho más electronegativo que el hidrógeno, por lo que el enlace HF es muy polar . El hidrógeno es un átomo muy pequeño, por lo que su carga positiva parcial se concentra en un área pequeña . Cuando este hidrógeno se acerca a un átomo de flúor en una molécula adyacente, es fuertemente atraído por uno de los pares de electrones solitarios del flúor . A esta fuerza la llamamos enlace de hidrógeno .
Definición de enlace de hidrógeno
Un enlace de hidrógeno es la atracción electrostática entre un átomo de hidrógeno unido covalentemente a un átomo extremadamente electronegativo y otro átomo electronegativo con un par solitario de electrones.

No todos los elementos pueden formar enlaces de hidrógeno. De hecho, solo tres pueden: flúor, oxígeno y nitrógeno. Para formar un enlace de hidrógeno, se necesita un átomo de hidrógeno unido a un átomo muy electronegativo que tenga un solo par de electrones, y solo estos tres elementos son lo suficientemente electronegativos.
Importante
Aunque el cloro también es teóricamente lo suficientemente electronegativo para formar enlaces de hidrógeno, es un átomo más grande. Veamos el ácido clorhídrico, HCl. La carga negativa de su único par de electrones se extiende sobre un área mayor y no es lo suficientemente fuerte para atraer al átomo de hidrógeno parcialmente positivo. Entonces, el cloro no puede formarse enlaces de hidrógeno.
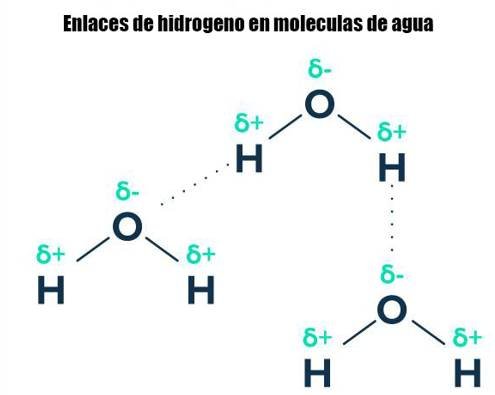
Las moléculas comunes que forman enlaces de hidrógeno incluyen agua amoníaco
y fluoruro de hidrógeno. Representamos estos bonos usando una línea discontinua, como se muestra a continuación.
Los enlaces de hidrógeno son mucho más fuertes que las fuerzas dipolo-dipolo permanentes y las fuerzas de dispersión. Requieren más energía para superar. Volviendo a nuestro ejemplo, ahora sabemos que es por eso que HF tiene un punto de ebullición mucho más alto que HBr. Sin embargo, los enlaces de hidrógeno son solo 1/10 de la fuerza de los enlaces covalentes. Esta es la razón por la que el carbono se sublima a temperaturas tan altas: se necesita mucha más energía para romper los fuertes enlaces covalentes entre los átomos.
Ejemplos de fuerzas intermoleculares
Veamos algunas moléculas comunes y predigamos las fuerzas intermoleculares que experimentan.
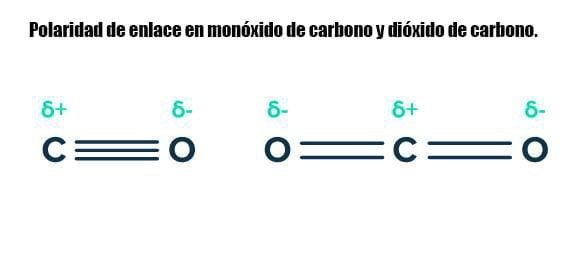
El monóxido de carbono CO es una molécula polar y también tiene fuerzas dipolo-dipolo permanentes y fuerzas de van der Waals entre moléculas. Por otro lado, el dióxido de carbono solo experimenta fuerzas de van der Waals . Aunque contiene enlaces polares, es una molécula simétrica, por lo que los momentos dipolares se anulan entre sí.
El metano y el amoníaco
son moléculas de tamaño similar. Por lo tanto, experimentan fuerzas de van der Waals de fuerza similar , que también conocemos como fuerzas de dispersión . Sin embargo, el punto de ebullición del amoníaco es mucho más alto que el punto de ebullición del metano. Esto se debe a que las moléculas de amoníaco pueden formar puentes de hidrógeno entre sí, pero las moléculas de metano no. De hecho, el metano ni siquiera tiene fuerzas dipolo-dipolo permanentes ya que todos sus enlaces son no polares. Los enlaces de hidrógeno son mucho más fuertes que las fuerzas de van der Waals, por lo que requieren mucha más energía para vencer y hervir la sustancia.

Conclusiones
- Las fuerzas intramoleculares son fuerzas dentro de las moléculas, mientras que las fuerzas intermoleculares son fuerzas entre moléculas. Las fuerzas intramoleculares son mucho más fuertes que las fuerzas intermoleculares.
- Polaridad determina el tipo de fuerzas intermoleculares entre moléculas.
- Las fuerzas de Van der Waals, también conocidas como fuerzas de London o fuerzas de dispersión, se encuentran entre todas las moléculas y son causadas por dipolos temporales. Estos dipolos temporales se deben al movimiento aleatorio de electrones y crean dipolos inducidos en moléculas vecinas.
- Las fuerzas dipolo-dipolo permanentes se encuentran entre moléculas con un momento bipolar. Son más fuertes que las fuerzas de van der Waals.
- Los enlaces de hidrógeno son el tipo más fuerte de fuerza intermolecular. Se encuentran entre moléculas que contienen un átomo de flúor, oxígeno o nitrógeno, unido a un átomo de hidrógeno.
Preguntas frecuentes
Las fuerzas intermoleculares son fuerzas entre moléculas. Los tres tipos son fuerzas de van der Waals, que también se conocen como fuerzas de dispersión, fuerzas permanentes dipolo-dipolo y enlaces de hidrógeno. ¿El diamante tiene fuerzas intermoleculares?
El diamante forma una red covalente gigante, no simples moléculas covalentes. Aunque existen fuerzas de van der Waals débiles entre los diamantes individuales, para derretir el diamante debe superar los fuertes enlaces covalentes dentro de la estructura gigante.
Los tres tipos de atracción son las fuerzas de van der Waals, las fuerzas permanentes dipolo-dipolo y los enlaces de hidrógeno. ¿Son fuertes las fuerzas intermoleculares?
Las fuerzas intermoleculares son débiles en comparación con las fuerzas intramoleculares, como los enlaces covalentes, iónicos y metálicos. Esta es la razón por la que las moléculas covalentes simples tienen puntos de fusión y ebullición mucho más bajos que las sustancias iónicas, los metales y las estructuras covalentes gigantes.
Fuerzas entre moléculas.
Fuerzas dentro de una molécula.
Las fuerzas intramoleculares son mucho más fuertes que las fuerzas intermoleculares.
Enlaces de hidrógeno.
Las fuerzas de van der Waals
Dos átomos con electronegatividades diferentes.
El movimiento aleatorio de electrones en la primera molécula crea un dipolo temporal. El dipolo temporal induce un dipolo en la segunda molécula. Los dipolos de carga opuesta se atraen entre sí.
aumenta
Ambos involucran dipolos. Ambos son tipos de fuerza intermolecular. Las fuerzas de Van der Waals tienen lugar entre todas las moléculas e involucran dipolos temporales e inducidos. Las fuerzas permanentes dipolo-dipolo son más fuertes, involucran dipolos permanentes y solo tienen lugar entre moléculas polares.
norte
Un átomo de hidrógeno unido a un átomo electronegativo con un par solitario de electrones. El átomo electronegativo debe ser F, N u O.
El oxígeno es mucho más electronegativo que el hidrógeno. Atrae el par de electrones de enlace hacia sí mismo y se convierte en δ-. Los átomos de hidrógeno ahora son δ+. Debido a que son tan pequeños, su carga parcial está densamente concentrada. Los átomos de hidrógeno son atraídos por uno de los pares de electrones solitarios en una molécula de agua vecina.
Criptón
El hexano es una molécula más grande que el propano y, por lo tanto, tiene más electrones. Esto significa que experimenta fuerzas de van der Waals más fuertes entre las moléculas. Estas fuerzas requieren más energía para superarse, lo que le da al hexano un punto de ebullición más alto.
▶️ Índice:





