Ácidos y bases: ¿Alguna vez se ha preguntado qué hace que una tableta antiácida sea tan efectiva? ¿Qué hay de la pasta de dientes?
¿Qué son los ácidos y las bases?
¿De qué está hecha la crema que ayuda a aliviar el dolor causado por las picaduras de avispa? Todos estos son ejemplos cotidianos de reacciones de neutralización entre ácidos y bases.
Existen múltiples definiciones diferentes de ácidos y bases, dependiendo de a quién le preguntes. Tome ácidos, por ejemplo.
- El físico sueco convertido en químico Svanthe Arrhenius definió por primera vez un ácido en 1884 como una sustancia que se disocia en iones de hidrógeno en solución .
- En 1923, dos científicos llamados Johannes Nicolaus Brønsted y Thomas Martin Lowry llegaron de forma independiente a una teoría diferente de ácidos y bases. Dijeron que un ácido es un donante de protones .
- También en 1923, Gilbert N. Lewis definió un ácido como un aceptor de pares de electrones .
Información importante
Un ion de hidrógeno es en realidad solo un protón. Los átomos de hidrógeno contienen un protón y un electrón. Retire el electrón en una reacción de ionización y todo lo que queda es un protón.
Definición de ácido
Un ácido es un donador de protones.
Los ácidos monopróticos donan solo un protón por molécula de ácido en una solución, mientras que los ácidos dipróticos donan dos.
La palabra ácido proviene del término latino ‘ acidus ‘, que significa agrio. Los ácidos tiñen de rojo el papel de tornasol azul húmedo. En cambio, las bases tiñen de azul el papel tornasol rojo y tienen una textura jabonosa.
Definición de Base
Una base es un aceptor de protones.
Los ácidos y las bases se disocian en solución . Esto significa que se dividen en iones . Por ejemplo, los ácidos siempre se descomponen en protones y un ion negativo, mientras que las bases se disocian en iones de hidróxido y un ion positivo.
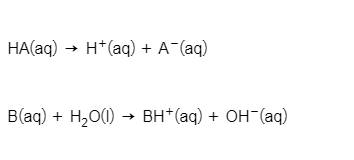
Consejo de estudio: no todas las bases contienen el grupo OH. Explorará otras bases como el amoníaco
Ácidos y bases conjugados
También puedes encontrar ácidos y bases conjugados.
Definición de Acido Conjugados
Un ácido conjugado es una base que ha ganado un protón, mientras que una base conjugada es un ácido que ha perdido un protón.
Los ácidos y las bases vienen con un ácido o una base conjugados emparejados. Por ejemplo, el ácido conjugado del amoníaco es amonio,
Ácido base conjugado
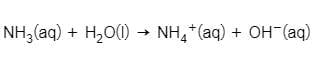
Reacciones de neutralización
Los ácidos y las bases reaccionan juntos en las reacciones de neutralización.
Definición de neutralización
Una reacción de neutralización es una reacción entre un ácido y una base.
Las reacciones de neutralización forman sales . Las sales son compuestos iónicos que consisten en iones positivos y negativos unidos en una red gigante. Para nombrarlos, enunciamos primero el catión (ión positivo) seguido del anión (ión negativo). Por ejemplo, el cloruro de sodio, que en realidad es solo sal de mesa común. Otro ejemplo de sal es el cloruro de calcio, que se utiliza para descongelar carreteras.

Figura 1 –
Cloruro de sodio. Los iones de sodio positivos (púrpura) y los iones de cloruro negativos (verde) están dispuestos en una estructura reticular gigante
Para neutralizar completamente una solución, se agrega solo la base suficiente para que reaccione con todo el ácido: no debe quedar ni ácido ni base sobrante.
Definición de Neutra
En una solución neutra , las concentraciones de iones de hidrógeno e hidróxido son iguales.
Como mencionamos anteriormente, tomar tabletas antiácidas, cepillarse los dientes y calmar las picaduras de avispas implican reacciones de neutralización. Los comprimidos antiácidos contienen bases como el hidróxido de magnesio , que neutralizan el exceso de ácido clorhídrico producido por el estómago. Por otro lado, la pasta de dientes es alcalina y reacciona con los ácidos producidos por las bacterias que viven en la boca. Las picaduras de avispas también son alcalinas. Así, las cremas y bálsamos suelen contener ácidos para neutralizar el escozor y calmar la zona afectada.
Definición de álcali
Un álcali es una base que es soluble en agua.
Ácidos y bases concentrados y diluidos
Probablemente hayas oído hablar de los peligros de los ácidos y las imágenes de señales de advertencia corrosivas llenan tu cabeza. Si bien es cierto que tanto los ácidos como las bases pueden ser extremadamente peligrosos, generalmente solo debe preocuparse por los ácidos y las bases concentrados .
Definición de Concentración
Concentración se refiere al número de moléculas de ácido o base en solución. Un ácido o base concentrado contiene muchas moléculas disueltas en solución, mientras que un ácido o base diluido contiene menos.
Ácidos y bases fuertes y débiles
Echa un vistazo a las siguientes ecuaciones:
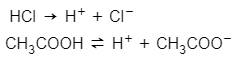
Tanto el ácido clorhídrico, HCI como el ácido etanoico son ácidos, tal como lo sugieren sus nombres. Ambos se disocian para donar protones en solución. Sin embargo, notará algo diferente en sus ecuaciones. Mientras que la reacción del ácido clorhídrico se completa, la del ácido etanoico es reversible. Esto sucede porque el ácido clorhídrico es un ácido fuerte mientras que el ácido etanoico es débil .
Definición de ácidos y bases
Los ácidos y bases fuertes son ácidos y bases que se disocian completamente en solución. A diferencia de, ácidos y bases débiles sólo se disocia parcialmente en solución.
Los ácidos fuertes incluyen el ácido clorhídrico, que se encuentra en los jugos gástricos, y el ácido sulfúrico. Los ácidos débiles incluyen el ácido etanoico, que se encuentra en el vinagre de malta, y el ácido cítrico, que se encuentra en las frutas cítricas como los limones. Las bases fuertes incluyen hidróxido de sodio, mientras que las bases débiles incluyen amoníaco. Explorará más los ácidos y las bases débiles en Ácidos y bases débiles.
Aunque la diferencia entre un ácido fuerte y débil puede parecer trivial, se vuelve importante al calcular pH, como verás más adelante. Pero antes de explorar eso, necesitamos definir qué pH en realidad es.
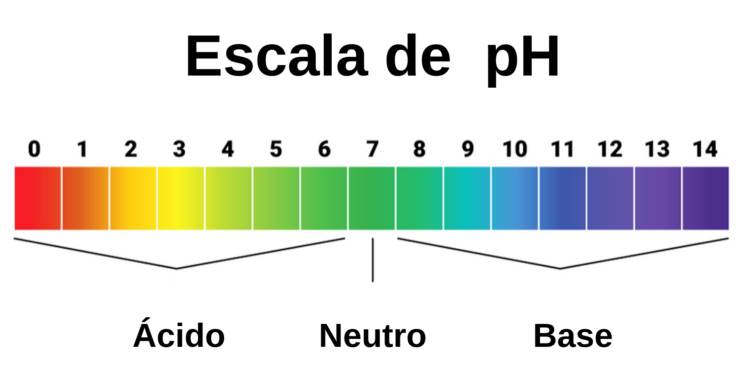
¿Qué es la escala de pH?
Es una medida de iones de hidrógeno concentración en solución.
La escala de pH fue inventada por un cervecero y químico danés llamado Søren Peder Lauritz Sørensen, que buscaba controlar la acidez de su cerveza. Soluciones con un alto ion de hidrógeno concentración tienen un pH bajo y viceversa.
Ahora sabes que los ácidos liberan protones (iones de hidrógeno) en solución. Esto significa que los ácidos tienen un pH bajo. Por otro lado, las bases tienen un pH alto.

Cálculo de pH
Calculador pH puede ser un poco complicado. Hay muchas ecuaciones que necesitas aprender, y es fácil confundirse entre moles y concentraciones.
La siguiente tabla le brinda algunos de los valores que necesita comprender para calcular pH, así como las ecuaciones que los unen.
En artículos posteriores, exploraremos todos estos valores con mayor detalle y lo guiaremos a través de los diferentes métodos para calcular el pH. Sin embargo, el proceso se puede resumir con el siguiente diagrama de flujo:
Medición de pH
Si está llevando a cabo una reacción ácido-base como una neutralización, que exploraremos a continuación, es posible que desee conocer el pH de una solución a intervalos regulares.
Calcular el pH cada vez puede ser un poco laborioso. Afortunadamente, tenemos diferentes formas de encontrar el pH instantáneamente.
- Los indicadores son sustancias que muestran un cambio observable distinto cuando cambian las condiciones en las que se encuentran. Esto es más comúnmente un cambio de color. El indicador universal es una mezcla de diferentes indicadores que abarca todo el espectro de colores según si una sustancia es ácida o alcalina.
- Los medidores de pH son instrumentos digitales que miden con precisión el pH de una solución. Lo hacen midiendo las diferencias en la actividad eléctrica.

¿Qué son las soluciones tampón?
Una solución tampón es una solución que mantiene un pH constante cuando se le agregan pequeñas cantidades de ácido o álcali.
En Soluciones tampón, aprenderá cómo funcionan estas soluciones extraordinariamente útiles. Hay muchos sistemas que simplemente no funcionarían si su pH fluctuara fuera de un rango estrecho, como su sistema circulatorio.
Importante
Los pH de sangre es mantenida por tres sistemas, más notablemente por uno llamado el sistema amortiguador de bicarbonato . Una constante pH. Se necesita alrededor de 7,4 para mantener las condiciones óptimas para la actividad enzimática. Cuando sus células respiran, se liberan en el torrente sanguíneo. Este reacciona con el agua para convertirse en el ion bicarbonato,
que existe en equilibrio con el ácido carbónico
.
Cualquier ácido producido por la actividad celular, por ejemplo, el ácido láctico, es neutralizado por iones de bicarbonato, mientras que cualquier base es neutralizada por ácido carbónico. En general, esto mantiene un pH constante.
¿Qué son las titulaciones?
Suponga que tiene una solución de ácido clorhídrico pero no está seguro de cuál es su concentración es. Una forma común de averiguar la concentración de un ácido o base desconocido es a través de una reacción de titulación . Haces esto neutralizando un volumen fijo de un ácido o base de conocida concentración con tu ácido o base de desconocido concentración, y midiendo el volumen de sustancia desconocida necesaria.
Para realizar con precisión una titulación, es necesario conocer su punto de equivalencia.
Definición de punto de equivalencia
El punto de equivalencia es el punto donde se ha agregado suficiente base para neutralizar suficientemente un ácido en solución, o viceversa.
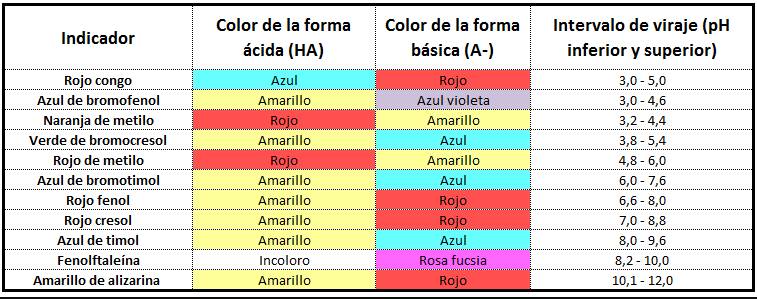
Para determinar cuándo has alcanzado el punto de equivalencia, utilizas un indicador, como mencionamos anteriormente. Los indicadores son útiles porque cambian de color en un momento específico pH. Esto se conoce como el punto final .
Si el punto final de una titulación es el mismo que su punto de equivalencia, puede usar el cambio de color del indicador para saber cuándo ha agregado suficiente base para neutralizar el ácido, o viceversa. A continuación, puede utilizar la ecuación química de la reacción para calcular la concentración del ácido o base desconocidos. Aprenderá más sobre esto en Curvas de pH y titulaciones.
Curvas de pH e indicadores adecuados
Trazando el pH el cambio en una reacción de neutralización contra el volumen de ácido o base agregado produce un gráfico curvo conocido como curva de pH . Tiene tres secciones diferenciadas:
- Un tramo inicial de poca pendiente, donde el pH apenas cambia.
- Una sección de fuerte pendiente, donde el pH cambia rápidamente.
- Otro tramo de poca pendiente, donde el pH apenas cambia.
El punto de equivalencia de una titulación se encuentra en el medio de esta sección de fuerte pendiente. Si el punto final de un indicador también se encuentra en esta sección, puede utilizar el indicador en su titulación.
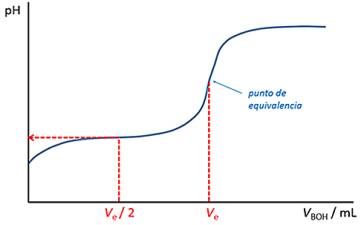
Curva de pH para la adición de una base fuerte a un ácido débil. Se muestran los puntos finales de dos indicadores. En este caso, la fenolftaleína sería un indicador adecuado, ya que su punto final se encuentra en la sección de pendiente pronunciada del gráfico, que también contiene el punto de equivalencia.
También te puede Interesar: Palabras con mb ✓ Oraciones ✓ Tipos ✓ Sustantivos Adjetivos ✓ Verbos
Realización de valoraciones
Una actividad práctica divertida podría ser realizar una titulación simple o una reacción de neutralización general. De hecho, probablemente hará muchas titulaciones a lo largo de sus estudios. Si está realizando una titulación, asegúrese de utilizar un indicador adecuado, pero también podría utilizar un medidor de pH. Veamos el proceso usando ácido clorhídrico e hidróxido de sodio.
- Mida 30
de HCI usando un matraz volumétrico. Vierta la solución en un matraz cónico.
- Agregue 2-3 gotas de su indicador y agite el matraz.
- Enjuague una bureta, primero con agua destilada y luego con
. Configure la bureta usando un soporte y una abrazadera para que quede suspendida sobre el matraz cónico.
- Llene la bureta con su titulador. Tenga en cuenta el valor de esta solución que se muestra en la bureta. Este es su valor inicial.
- Agregue el titulador al matraz cónico en
intervalos, agitando después de cada adición, hasta que la solución en el matraz cónico cambie de color. Tenga en cuenta el valor que se muestra en la bureta. Este es su valor final.
- Para calcular el título, reste su valor final de su valor inicial. Esto le da el volumen de titulador agregado al matraz.
- Repita el experimento nuevamente hasta que tenga tres valores de título uno dentro
del otro. Cuando llegue al final de la titulación, cerca del punto de cambio de color, agregue el titulador gota a gota. El cambio de color tiene lugar en un rango de volumen muy pequeño, por lo que agregar el titulador en cantidades reducidas le permite ser más preciso.
Si está usando un pH medidor, úselo para medir el pH de la solución en el matraz cónico cada vez que agregue más titrante. A medida que se acerque al punto de cambio de color, agregue el titulador en cantidades más pequeñas como se explicó anteriormente.
Esta es la configuración para una titulación típica.

Titulaciones tienen muchas aplicaciones útiles en la vida cotidiana. Por ejemplo, se utilizan para determinar el grado de contaminación de las aguas residuales y para conocer el contenido nutricional de ciertos alimentos, como la proporción de ácidos grasos saturados e insaturados presentes. La industria cosmética también utilizó titulaciones para asegurarse de que la pH de sus productos se mantiene dentro de un rango seguro para la piel humana.
Ácidos y bases: conclusiones clave
- Hay muchas definiciones diferentes de ácidos y bases. La definición de Brønsted-Lowry define a los ácidos como donantes de protones y a las bases como aceptores de protones.
- Los ácidos y las bases se disocian en solución. Los ácidos se disocian en iones de hidrógeno y las bases se disocian en iones de hidróxido.
- Mientras que los ácidos y bases fuertes se disocian completamente en solución, ácidos y bases débiles solo se disocia parcialmente. Concentración es una medida del número de moléculas de ácido o base en solución.
- Una reacción de neutralización es una reacción entre un ácido y una base para formar una sal. Una solución neutra contiene concentraciones iguales de iones de hidrógeno e hidróxido.
- pH es una medida de la concentración de iones de hidrógeno en solución. Podemos calcular el pH de varias soluciones utilizando valores como Ka, Kb, Kw y pOH.
- Las reacciones de titulación te ayudan a calcular la concentración de un ácido o una base. Utilizan indicadores para mostrar cuando se ha alcanzado el punto de equivalencia de la reacción.
- Las soluciones amortiguadoras son soluciones que mantienen una constante pH cuando se les añaden pequeñas cantidades de ácidos o bases.
Preguntas Frecuentes sobre Ácidos y Bases
Hay múltiples definiciones diferentes de ácidos y bases. Sin embargo, la definición de Brønsted-Lowry define a los ácidos como donantes de protones y a las bases como aceptores de protones.
Puedes usar las diferencias en el pH para distinguir entre ácidos y bases. Los ácidos tienen un pH bajo por debajo de 7 mientras que las bases tienen un pH alto por encima de 7. Para medir el pH, usamos un indicador universal o un medidor de pH.
Los ácidos conjugados son bases que han ganado un protón, mientras que las bases conjugadas son ácidos que han perdido un protón. Cada ácido y base tiene un ácido o base conjugado emparejado.
Los álcalis son bases que son solubles en agua. ¡Esto significa que todos los álcalis son bases pero no todas las bases son álcalis!
Una forma de definir ácidos y bases es usando las definiciones de Arrhenius. Un ácido de Arrhenius es una sustancia que dona un protón en solución, mientras que una base de Arrhenius da iones de hidróxido en solución.
Una sustancia que se disocia en iones de hidrógeno en solución.
Un donante de protones.
Un aceptor de pares de electrones.
– Ambos son ácidos que donan protones en solución. – Los ácidos monopróticos donan un ion de hidrógeno (protón) por molécula de ácido en solución, mientras que los ácidos dipróticos donan dos.
Un aceptor de protones.
Disociar
Un ácido que ha perdido un protón.
Una reacción entre un ácido y una base.
Un compuesto iónico que consta de iones positivos y negativos unidos en una red gigante.
Una solución neutra tiene un pH de exactamente 7.
– La concentración se refiere al número de moléculas de ácido disueltas en una solución. – Un ácido o base concentrado contiene muchas moléculas disueltas en solución, mientras que un ácido o base diluido contiene menos.
Un ácido fuerte se disocia completamente en solución.
Una solución que mantiene un pH constante cuando se le agregan pequeñas cantidades de ácido o álcali.
El punto de equivalencia de una titulación es el punto donde se ha agregado suficiente base para neutralizar suficientemente un ácido en solución, o viceversa.
Un donante de protones.
Un aceptor de protones.
Una base que ha aceptado un protón de un ácido.
Un ácido que ha perdido un protón.
Sustancia que puede comportarse tanto como ácido como base.
Una reacción entre un ácido y una base
Sustancia que puede comportarse como ácido y como base.
endotérmico
Una solución neutra tiene concentraciones iguales de iones de hidrógeno e hidróxido.
Eso depende
2
Por encima de 7
Por encima de 7
7 ¿Qué es un ácido fuerte?
Un aceptor de protones que se disocia completamente en solución.
Ácido clorhídrico
Hidróxido de sodio
Un ácido que solo se disocia parcialmente en solución.
Una base que solo se disocia parcialmente en solución.
– Concentrado significa que hay muchas moléculas de ácido disueltas en la solución. – Fuerte significa que todas las moléculas de ácido se han disociado en iones.
Una titulación es una reacción en la que encontramos la concentración desconocida de una solución, conocida como valorante, añadiéndola gradualmente a una solución de concentración conocida hasta que se produce un cambio perceptible.
Un gráfico producido a partir de una titulación que muestra cómo cambia el pH de una solución cuando se le agrega un ácido o un álcali.
Sustancia que experimenta un cambio observable cuando cambian las condiciones de su disolución.
El punto donde el indicador cambia de color.
– Tiene un cambio de color distintivo. – El cambio de color ocurre en un rango de pH corto. – El punto final es el mismo que el punto de equivalencia de la titulación.
El punto donde se ha agregado suficiente base para neutralizar el ácido o viceversa.
21.3
La sustancia añadida de una bureta en una reacción de titulación.
Una solución que mantiene un pH constante cuando se le agregan pequeñas cantidades de ácido o álcali.
Mezclar un ácido débil con una de sus sales.
Mezclar una base débil con una de sus sales.
CH 3 COO – Na +
CH 3 COO – Na +
El punto donde la mitad del ácido en solución ha sido neutralizado por una base.
A la mitad de la neutralización, pKa = pH. Esto se debe a que [A – ] = [HA].
▶️ Índice:




